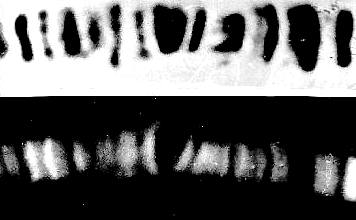
Riesenchromosomen (polytäne Chromosomen), wie hier z. B. bei Drosophila melanogaster zeichnen sich durch ein Bandenmuster aus. Die Banden - Heterochromatin, bzw. Histon-DNS-Komplexe enthaltend - sind mit konventionellen Chromosomenfarbstoffen (hier Orcein) leicht anfärbbar und damit identifizierbar.(oberes Bild) Die dazwischenliegenden Interbanden enthalten - obwohl nur wenig DNS vorhanden ist - die eigentlichen aktiven Gene. In diesen Bereichen läßt sich mit Hilfe der indirekten Immunfluoreszenz DNS-abhängige RNS-Polymerase nachweisen (die zur Transkription benötigt wird) (unteres Bild). (M. JAMRICH, A. L. GREENLEAF, E. K. F. BAUTZ, Heidelberg, 1977)
In den letzten beiden Jahrzehnten sind spezielle Färbeverfahren (Bandierungstechniken) zur Markierung bestimmter Chromosomenabschnitte (Bänder) entwickelt worden. Je nach Vorbehandlung der Chromosomen und den verwendeten Farbstoffen (bzw. Fluorochromen) unterscheidet man zwischen Q-, C-, G-, R-Bandierung usw. Am gebräuchlichsLen sind:
|
Q-Bandierung (Q-Banden). Q-Banden erhält man nach Fluorochromierung der Chromosomen mit Quinacrin (=Atebrin). Sie sind an einer Gelbfluoreszenz unterschiedlicher Intensität erkennbar. Gefärbt wird vorwiegend das Heterochromatin. Quinacrin bindet sowohl an AT- als auch an GC-reiche DNS-Abschnitte, doch lediglich der AT-Quinacin-Komplex fluoresziert. Da AT-reiche Abschnitte im Heterochromatin reichlicher als im Euchromatin vertreten sind, wird ersteres preferentiell markiert. Die unterschiedliche Intensität einzelner Banden spiegelt den unterschiedlichen AT-Gehalt wider. Andere Fluorochrome, wie DAPI oder Hoechst 33258, führen ebenfalls zu charakteristischen, reproduzierbaren Mustern; jedes der Fluorochrome induziert ein ihm spezifisches. Mit anderen Worten: Die Bindungseigenschaften und Spezifitäten der Fluorochrome beruhen nicht ausschließlich auf ihrer Affinität zu AT-reichen Abschnitten. Vielmehr beeinflußt deren Verteilung und deren Assoziation mit anderen Molekülen (z.B. Histonen) die Bindungseigenschaften der Fluorochrome. |
|
| C-Bandierung (C-Banden). Der Name geht auf die englischen Begriffe centromeric oder constitutive Heterochromatin zurück. Die Präparate werden durch alkalische Denaturierung vorbehandelt, wodurch die DNS weitgehend depurinisiert wird. Nach dem Auswaschen von Proteinen, Purinen und anderen denaturierten Molekülen wird die verbliebene DNS wieder renaturiert und dann mit Giemsa-Lösung (aus Methylenazur, Methylenviolett, Methylenblau und Eosin bestehend) gefärbt. Heterochromatin färbt sich intensiv, die übrigen Chromosomenabschnitte absorbieren nur wenig Farbstoff. Die C-Bandierung erwies sich gerade zur Charakterisierung pflanzlicher Chromosomen als vorteilhaft. |
|
| G-Bandierung (G-Banden). Ein Verfahren, das für tierische Zellen brauchbar, für pflanzliche unbrauchbar ist. Ähnlich der C-Bandierung, doch ohne Vorbehandlung. Pflanzliche Chromosomen werden einheitlich durchgefärbt. |
|
| R-Bandierung (R-Banden), (= reverse banding). Hier werden GC-reiche Abschnitte, die für Euchromatin charakteristisch sind, markiert. |
|
| Hy-Bandierung (Hy-Banden). Diese Methode wurde speziell für pflanzliche Zellen entwickelt. Jene werden mit heißer HCl (= hydrochloric acid) vorbehandelt und dann mit Karminessigsäure gefärbt. Das Muster der Hy-Banden unterscheidet sich von dem der C-Banden. Offensichtlich beeinflußt hier die Bindung von Protein an DNS, und dessen mehr oder weniger vollständige Extraktion, das Bindungsvermögen von Karminessigsäure. |
|
Durch Abwandlung, Wahl weiterer Farbstoffe und Fluorochrome (z.B. durch Doppelmarkierung mit Chromomycin A3 und DAPI) kann das Auflösungsvermögen der Bandierungstechniken gesteigert werden. Viele der Ansätze eignen sich unmodifiziert für tierische Chromosomen, führen aber bei pflanzlichen zu beträchtlichen Schwierigkeiten, was die Einsatzmöglichkeiten erheblich einschränkt. Die Ursachen hierfür sind meist ungeklärt. Das durch Bandierungstechniken erzeugte Muster erreicht bei pflanzlichen Chromosomen niemals den Auflösungsstandard, der bei tierischen Chromosomen üblich ist.
Auffallend ist die Konstanz der Verteilungsmuster von konstitutivem Heterochromatin und übrigem Chromatin bei vielen Arten mit intraspezifisch variablen Karyotypen. Intraspezifische Unterschiede im Bandierungsmuster wurden in Trillium-Populationen ( I. FUKUDA und V. GRANT, 1980) und bei polymorphen Scilla-Arten (J. GREILHUBER und F. SPETA, Botanisches Institut der Universität Wien, 1977) beschrieben. Bei Scilla sind die Unterschiede minimal, Gemeinsamkeiten überwiegen. D. SCHWEIZER und F. EHRENDORFER (ebenfalls Botanisches Institut der Universität Wien) konnten die Karyotypen von sechs Arten der Compositengattung Anacyclus nach C-Bandierung leicht auseinanderhalten, obwohl sie sich strukturell sehr ähneln und bei konventioneller Färbung nur schwer zu identifizieren sind. Die Analyse der Gattung Scilla gab Aufschlüsse über die Veränderung der Chromosomenstruktur während adaptiver Radiation.
Oft - doch nicht immer - ist die DNS-Zunahme dabei auf Heterochromatinzunahme, also auf Zunahme nicht-codierender Abschnitte zurückzuführen. In anderen Fällen wurde eine Abnahme der Gesamt-DNS-Menge beobachtet, obwohl der Anteil an C-Banden zunahm. Artneubildungen sind vielfach von einer Umstrukturierung des Heterochromatinanteils begleitet.
Auf Maischromosomen sind eine Anzahl von Anschwellungen (Knöpfen) erkennbar. Diese können an 23 verschiedenen Positionen lokalisiert sein. Ihre Zahl schwankt zwischen 0 und 18 und ist sortenspezifisch. Die Chromosomen der im Norden Nordamerikas angebauten Sorten haben keine oder nur sehr wenige Knöpfe, die der im Süden und im Mittelamerika kultivierten Sorten hingegen sind besonders knopfreich. Die Knöpfe enthalten Heterochromatin und sind daher als C-Banden identifizierbar. Das Süd-Nord-Gefälle belegt erneut, daß auch die Menge nichtcodierender DNS einem starken Selektionsdruck unterliegt. Wegen der im Norden kürzeren Vegetationsperiode sind Sorten mit wenig DNS im Vorteil. Auf die DNS-Menge bezogen betragen die Unterschiede bis zu 37%. Diese Beobachtungen sind zugleich ein Indiz dafür, daß das genetische Material selbst innerhalb einer Art starken Umstrukturierungen unterworfen ist (H. J. PRICE, Texas A & M University, College Station, 1987).
Bandierungstechniken sind zu wertvollen, aber nicht immer einfach beherrschbaren Hilfsmitteln geworden. Es gibt nur wenige Arbeitsgruppen, die verstehen, sie effizient zu nutzen. Es gibt daher bisher auch noch nicht genügend Ergebnisse, um weitreichende (verallgemeinernde) Schlüsse über die Evolution dieser Muster und ihre Bedeutung für die Evolution der Pflanzen zu ziehen. Die Mehrzahl der Untersuchungen wurde an Monokotyledonen (Liliaceen und Gramineen) durchgeführt. Nur wenige Dikotyledonen besitzen große Chromosomen, an denen nach Bandierung Einzelheiten erkennbar wären.
|
|