Die Biochemie allen irdischen Lebens hängt zur Energiegewinnung von Oxidationsprozessen ab. Das Endprodukt von Stoffwechselwegen auf der Basis von Kohlenstoffverbindungen ist Kohlendioxid, das in die Atmosphäre freigesetzt wird. Zur Schließung des Kohlenstoffzyklus ist es notwendig, das Kohlendioxid wieder in die Nahrungskette einzuschleusen. Das einzige dazu befähigte Enzym ist die Ribulose-1,5-Bisphosphatcarboxylase (Rubisco). Es stellt den Anfang aller Nahrungsketten dar.
 In einigen Bakterien gibt es ein Enzym aus zwei identischen Untereinheiten. In höheren photosynthetisch aktiven Organismen ist das Enzym ein Sechzehnmer aus je acht identischen kleinen und großen Untereinheiten, wovon die großen Untereinheiten katalytisch aktiv sind.
In einigen Bakterien gibt es ein Enzym aus zwei identischen Untereinheiten. In höheren photosynthetisch aktiven Organismen ist das Enzym ein Sechzehnmer aus je acht identischen kleinen und großen Untereinheiten, wovon die großen Untereinheiten katalytisch aktiv sind.
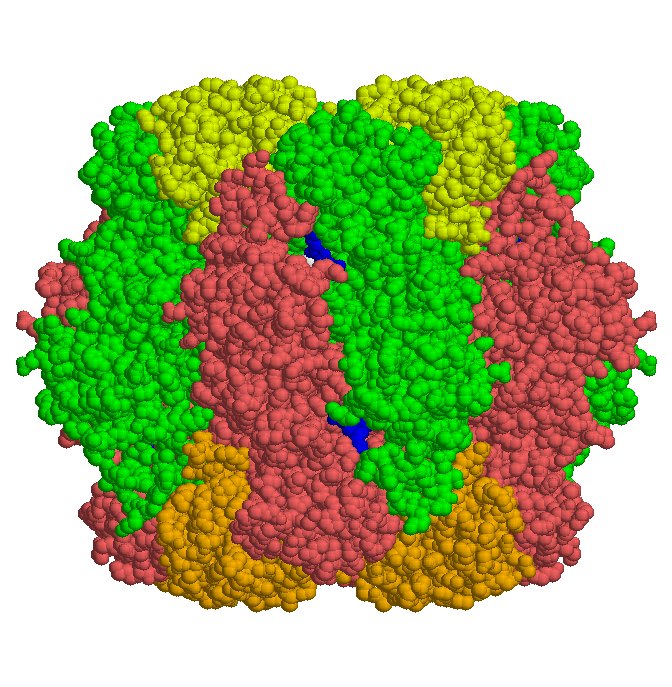
Die Strukturen der Enzyme aus Synechococcus, Tabak und Spinat sind aufgekärt worden. Hier ist der Enzymkomplex aus Spinat gezeigt: große (dunkel) und kleine (hell) Untereinheiten bilden je Ringe (rot und grün), die symmetrisch verzahnt ineinander stecken. Rechts eine Seitenansicht, unten ist ein Bild entlang der vierzähligen Symmetrieachse gezeigt.

Das Spinat-Enzym konnte auch als Komplex mit dem Substrat Ribulosebisphosphat kristallisiert werden (im Bild oben blau). Aus den Röntgenbeugungsdaten dieses Komplexes konnten Rückschlüsse auf den Reaktionsmechanismus und seine Stereochemie gezogen werden.
Im Folgenden wird in einem Script die Struktur des Enzyms gezeigt, in einem anderen der Reaktionsablauf.
Benutzungshinweis: maximieren Sie das sichtbare browser-Fenster (nicht benötigte Status/Task-Leisten ausschalten oder Automatisch im Hintergrund, Bildschirmauflösung 1024x768)