Der Begriff Toxin wurde ursprünglich für filtrierbare ( = subzelluläre) Stoffe benutzt, die Krankheiten auslösen. Als erstes wurde Diphtherietoxin als ein von Bakterien produziertes Gift erkannt (E. Roux & A. Yersin, Institute Pasteur 1888). Heute sind hunderte Toxine bekannt, deren Gemeinsamkeit die tödliche Wirkung auf lebende Zellen ist. Alle schädigen Zellmembranen oder deren Komponenten oder überwinden deren Schutzfunktion, um im Zellinneren Schaden anzurichten. Aufgrund ihrer komplexen Proteinstruktur haben sie spezifische Wirkorte. Sie können grob in einige Gruppen eingeteilt werden: Porin-ähnliche Toxine durchlöchern Zellwände, sodaß der Ionenhaushalt der betroffenen Zellen gestört wird und Nährstoffe und Energieträger verloren gehen; Toxine mit intrazellulärem Wirkort bilden in der Zellwand eine Struktur (Kanal), die die Einschleusung einer enzymatisch wirksamen Komponente erlaubt, die ihrerseits Zellfunktionen ausschaltet; eine weitere Gruppe bindet an oder modifiziert vorhandene Ionenkanäle und stört damit z.B. Reizleitungen. Auch Bacteriocine (bei E. coli Colicine) gehören funktionell zu den Toxinen, sie dienen dem Krieg der Bakterien untereinander und wirken hochspezifisch.
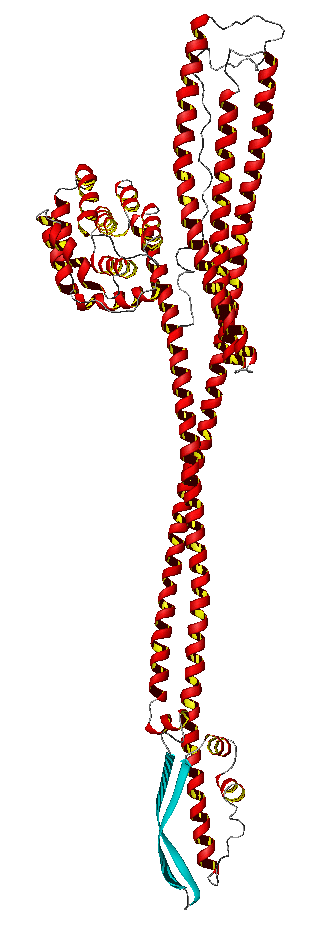 Kanalbildende Toxine kommen in zwei völlig unterschiedlichen Baumustern vor: Ein Typ benutzt ausgedehnte alpha-Helices zum Überbrücken einer Membran, der andere Typ benutzt zu Faßstrukturen zusammengesetzte beta-Faltblätter zur Porenbildung. Unabhängig vom Strukturtyp besteht für den Toxinproduzenten die Notwendigkeit des Schutzes vor Selbstmord: Das Toxin muß aus der Zelle in einer unschädlichen Form ausgeschleust werden und darf erst beim Treffen einer fremden Zielzelle in die aktive Form übergehen. Dies ist ein mehrstufiger Prozess. Die Toxin-Proteine werden in einer wasserlöslichen Form synthetisiert und aus der Produzentenzelle exportiert (rechtes Bild: Colicin Ia in der wasserlöslichen Konformation). In dieser Form diffundieren sie durch das Medium/den Blutkreislauf, bis sie auf eine geeignete Membran oder einen spezifischen Rezeptor darin treffen und dort binden. Darauf folgt eventuell eine Oligomerisierung. Durch Umfaltung von Proteindomänen geht die wasserlösliche in eine membrangängige Konformation über, die in der Membran verankert wird und dort einen Kanal bildet.
Kanalbildende Toxine kommen in zwei völlig unterschiedlichen Baumustern vor: Ein Typ benutzt ausgedehnte alpha-Helices zum Überbrücken einer Membran, der andere Typ benutzt zu Faßstrukturen zusammengesetzte beta-Faltblätter zur Porenbildung. Unabhängig vom Strukturtyp besteht für den Toxinproduzenten die Notwendigkeit des Schutzes vor Selbstmord: Das Toxin muß aus der Zelle in einer unschädlichen Form ausgeschleust werden und darf erst beim Treffen einer fremden Zielzelle in die aktive Form übergehen. Dies ist ein mehrstufiger Prozess. Die Toxin-Proteine werden in einer wasserlöslichen Form synthetisiert und aus der Produzentenzelle exportiert (rechtes Bild: Colicin Ia in der wasserlöslichen Konformation). In dieser Form diffundieren sie durch das Medium/den Blutkreislauf, bis sie auf eine geeignete Membran oder einen spezifischen Rezeptor darin treffen und dort binden. Darauf folgt eventuell eine Oligomerisierung. Durch Umfaltung von Proteindomänen geht die wasserlösliche in eine membrangängige Konformation über, die in der Membran verankert wird und dort einen Kanal bildet.
Die Strukturen einiger Toxine konnten für die wasserlösliche oder die membrangebundene Form aufgeklärt werden. Als Beispiele für Strukturtypen werden hier gezeigt:
A-B Toxine sind aus zwei Komponenten aufgebaut: eine bindende Domäne B sorgt dafür, daß eine enzymatisch aktive A-Domäne in die Zielzelle transportiert wird. Die aktive Domäne wird zur Freisetzung ins Zellinnere von dem Gesamtprotein abgespalten oder es handelt sich von vornherein um separate Proteine. Zu den A-B Toxinen gehören wohlbekannte Übeltäter: Diphtherietoxin modifiziert eine seltene Aminosäure (Diphtamid) im Elongationsfaktor 2 und blockiert damit die Proteinsynthese; Cholera- und Keuchhustentoxin adenylieren ein Regulationsprotein der Adenylatcyclase; Shigella-Toxin und das pflanzliche Ricin spalten eine essentielle Base der ribosomalen 28S rRNA ab.
Stellvertretend für diese Gruppe werden hier besprochen:
Viele natürlich vorkommende Gifte enthalten Toxine, deren Peptidketten aus 60 - 70 Aminosäuren aufgebaut sind. Die Gruppe der alpha-Neurotoxine blockiert die Wirkung des Transmitters Acetylcholin, indem der Rezeptor besetzt wird (z. B. Erabutoxin). Dendrotoxine blockieren Kaliumkanäle, das Scorpiontoxin Variante 3 blockiert Natriumkanäle.
| Erabutoxin b aus Laticanda semifasciata (Seeschlange) |
Dendrotoxin aus Dendropsis angusticeps (grüne Mamba) | Scorpion Toxin var. 3 aus Centuroides sculpturatus |
Literatur:
S Olsnes et al, Protein toxins with intracellular targets, Microb. Pathogen. 8 (1990) 163-168
RJ Read & PE Stein, Toxins, Curr. Opin. Struct. Biol. 3 (1993) 853-860
CL Sears & JB Kaper, Enteric bacterial toxins, Microbiol. Rev. 60 (1996) 167-215
V Cabiaux et al, Interaction with a lipid membrane: a key step in bacterial toxins virulence, Int. J. Biol. Macromol. 21 (1997) 285-289
E Gouaux, Channel-forming toxins: tales of transformation, Curr. Opin. Struct. Biol. 7 (1997) 566-573