Biologische Objekte können nur nach aufwendigen Vorbereitungen elektronenmikroskopisch bearbeitet werden. Die Gefahr der Artefaktbildung ist hoch, D. W. FAWCETT schrieb dazu (1964):
"Es muß vorbehaltlos zugegeben werden, daß wir keine objektiven Kriterien zur Beurteilung guter Strukturerhaltung haben. Vielleicht ist es eher ein Glaubenssatz der Morphologen als eine Frage des bewiesenen Tatbestandes, daß ein Bild, das scharf, zusammenhängend, geordnet, detailliert und allgemein ästhetisch ist, eher der Wirklichkeit zu entsprechen scheint als eines, das grob, ungeordnet und undeutlich ist. Jedes andere Kriterium als Leitschnur anzunehmen bedeutet, Unsorgfältigkeit und technisches Stümpertum zu ermuntern."
Jahrelange Erfahrungen und vergleichbare Ergebnisse, die nach Einsatz unterschiedlicher Methoden gewonnen wurden, gaben letztlich die Gewähr für die Zuverlässigkeit der Methoden und für die Aussage, daß man es tatsächlich mit real existierenden Strukturen zu tun hat. Biologische Präparate - selbst einzelne Zellen - sind meist zu groß und zu dick, um als Ganzes verwendet zu werden. In der Regel müssen Querschnitte angefertigt werden. Die Schnittechnik erfordert die Einhaltung folgender Schritte:
Fixierung des Materials, üblicherweise mit Glutaraldehyd (zur Stabilisierung der Proteinstrukturen) und Osmiumtetroxyd (zur Festigung von Membranen), dann Entwässerung.
Einbettung in Kunstharz (meist auf Epoxydbasis). Durch Imprägnierung werden die zellulären Strukturen stabilisiert. Ohne diese Verfestigung würden sie im Vakuum (im Elektronenmikroskop) kollabieren.
Schneiden des in Kunstharz eingeschlossenen Materials: Benötigt wird ein Ultramikrotom, mit dem Schnittdicken von 15-100 nm erzielt werden können. Ultramikrotome sind meist mit Glasmessern bestückt. Bruchkanten von Spiegelglas sind nämlich schärfer als Metallmesser, ihre Lebensdauer hingegen ist kurz. Als Alternative können Diamantmesser verwendet werden; sie sind langlebiger, doch wesentlich teurer.
Überführung der Schnitte auf einen Objektträger: Die Objektträger bestehen aus Kupfernetzchen, die von einem kohleverstärkten Kunststoffilm (Formvar) überzogen sind.
Kontrastierung: Es gibt zwei prinzipiell verschiedene Möglichkeiten der Kontrastierung: Bedampfung und "Färbung" mit Schwermetallionen. Bei der Bedampfung werden die Präparate (im Vakuum) einer Metalldampfwolke (meist: Platin oder Platin/Kohle, Gold, Vanadium, Chrom, Blei u.a.) ausgesetzt. Die Wolke entsteht bei der Erhitzung einer entsprechenden Metallelektrode, die in einem vorgegebenen Abstand und einem eingestellten Winkel zur Präparatoberfläche entfernt ist (=Schrägbedampfung). Durch reliefartige Präparatoberflächen bedingt, bildet sich ein ungleichmäßig strukturierter Metallfilm über dem Objekt aus (Reliefkontrast). Es gibt Fälle, in denen ein Abdruck von der Oberfläche (eine Replika) genommen wird. Dabei werden etwas dickere Metallfilme (oft kohleverstärkt) erzeugt, die vom Präparat abgezogen und dann als solche mikroskopiert werden. Bei der Kontrastierung durch Schwermetallionen werden die Präparate mit Uranylacetat- oder Bleicitratlösung behandelt. Die Salze werden von den Objekten unterschiedlich stark absorbiert, so daß später im elektronenmikroskopischen Bild unterschiedlich intensiv markierte Strukturen erscheinen. Man spricht von positive staining, wenn eine Struktur das Kontrastierungsmittel absorbiert hat oder wenn es von ihm eingelagert wird. Dem steht das negative staining gegenüber, bei dem sich die Metallionen (Phosphorwolframsäure, Uranylacetat, Uranyformiat u.a.) um die eigentlichen Strukturen herum lagern. Im Elektronenmikroskop ist demnach nicht die Struktur selbst, sondern die Umgebung durch hohen Kontrast gekennzeichnet. Negative staining wird in der Regel zur Sichtbarmachung von Makromolekülen und Molekülkomplexen (Ribosomen, Viren u.a.) eingesetzt. In der Regel muß ein spezifisches Spreitungsmittel zugesetzt werden, um ein Verklumpen der Moleküle zu unterbinden.
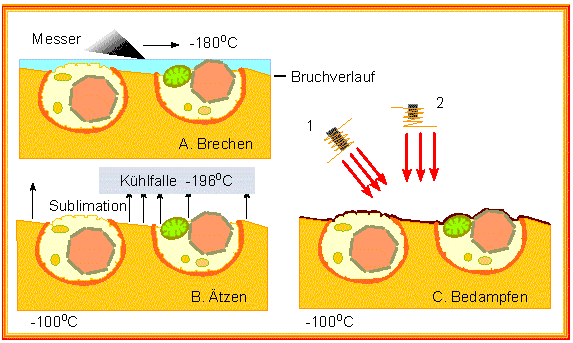
Gefrierverfahren
(z.B. Gefriertrocknung) sind in gewisser Hinsicht eine Alternative zur
chemischen Fixierung, oft ist die Strukturerhaltung besser. Der Gefrierbruch
und das Gefrierätzverfahren (H. MOOR und K. MÜHLETHALER; University
of California, Berkeley und Eidgenössische Hochschule Zürich,1963)
eignen sich nur für kleine Objekte: Zellen und subzellulare Strukturen.
Hierbei werden die Objekte eingefroren, und das gefrorene Material wird
mit Hilfe eines Glasmessers "gebrochen". Die Präparate splittern,
wobei die Bruchflächen entlang der Membranen oder zwischen zwei Membranhälften
verlaufen.
Wasser wird anschließend durch Gefriertrocknung entfernt. Es sublimiert, d.h., es geht von der festen, unter Umgehung der flüssigen, direkt in die Gasphase über. Das Präparat wird dadurch oberflächlich angeätzt. Es folgt nunmehr eine Schrägbedampfung, und der dabei erhaltene Abdruck wird abgezogen und mikroskopiert.
J.
E. HEUSER (Washington University, St. Louis) entwickelte Ende der siebziger
Jahre ein Schockgefrierverfahren (quick-freeze, deep-etch preparation of
samples), bei dem das Auskristallisieren des Wassers unterbunden wird.
Die (sehr kleinen) Objekte werden "schockartig" in flüssigen
Stickstoff überführt, wobei das Wasser einen glasförmigen
Zustand annimmt. Dies wiederum bewirkt eine wesentlich verbesserte Objekterhaltung.
Die Methode eignet sich zur Darstellung großer Moleküle und
Molekülkomplexe. Auch hier muß durch Bedampfung ein Abdruck
erstellt werden. Im Gegensatz zum negative staining kann ein dreidimensionales
Bild der Molekülstruktur gewonnen werden.
|