Chemische Eigenschaften eines Elementes leiten sich von der Elektronenkonfiguration der äußersten Schale, von den Valenzelektronen ab. Bei Kohlenstoff ist die erste Schale mit zwei Elektronen vollständig besetzt. Die zweite Schale enthält vier Elektronen, daher die "Vierwertigkeit".
Zur Erinnerung (Physikunterricht): Elektronen können als Partikel mit einer finiten Masse (0,9 x 10-27g) charakterisiert werden, aber auch als Welle zur Beschreibung relativer Aufenthaltswahrscheinlichkeiten im Raum. Erwin Schrödinger entwickelte 1926 mathematische Ausdrücke für die Bewegung von Elektronen in Abhängigkeit ihrer Energiezustände (Schrödingergleichungen, Wellengleichungen). Da eine exakte mathematische Lösung nicht möglich ist, begnügt man sich mit Näherungslösungen, den Wellenfunktionen. Je geringer der Energiegehalt eines Elektrons ist, desto besser wird die Näherung. Bildlich gesehen wird die Wahrscheinlichkeit errechnet, ein Elektron an irgendeiner bestimmten Stelle anzutreffen. Resultat ist eine "Wolke", die einen Mittelwert über Zeit und Raum beschreibt.
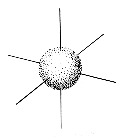
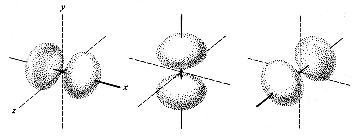
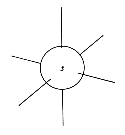
Die aus den Schrödingergleichungen abgeleiteten Elektronenwolken werden als Orbitale bezeichnet. Die Form der Orbitale ändert sich mit dem Energiegehalt. Die niedrigenergetischen s-Orbitale sind kugelsymmetrisch um den Atomkern, p-Orbitale haben dagegen einen "Wellenknoten" am Kern und je zwei Maxima entlang der (gedachten) Koordinaten eines kartesischen Systems.
 |
 |
 |
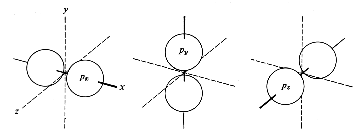 |
| s-Orbital | p-Orbitale |
Die hier gezeigten Bilder (obere Reihe Elektronendichte, untere Schema) der p-Orbitale gelten für die zweite Elektronenschale. In den höheren Schalen schwererer Atome enthalten die Wellenfunktionen mehr Knoten.
Die Besetzung der Orbitale mit Elektronen gehorcht dem Pauli-Prinzip:
Kohlenstoff hat demnach die Elektronenverteilung
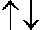 |
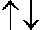 |
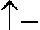 |
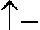 |
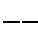 | |
| 1s | 2s | 2px | 2py | 2pz |
Diese Daten gelten für "nackte" Kohlenstoffatome. In der real-chemisch existierenden Welt sind Kohlenstoffatome an andere Atome gebunden: sich selbst (Diamant, Graphit), Wasserstoff, etc. Wenn die vier möglichen Liganden eines Kohlenstoffatoms gleich(wertig) sind, dürfen die vier für die chemischen Bindungen zuständigen Elektronen keine unterschiedlichen Energieniveaus haben. Um dies zu erreichen, müssen die energetisch unterschiedlichen 2s- und 2p-Orbitale hybridisiert werden. Dazu wird ein 2s-Elektron in das freie 2pz-Orbital "befördert": es gibt nun vier gleichwertige ungepaarte Elektronen in vier gleichwertigen Hybridorbitalen (sp3):
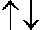 |
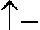 |
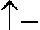 |
 |
 | |
| 1s | 2sp3 | ||||
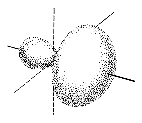 |
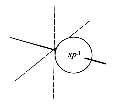 |
| ein sp3-Orbital | |
Durch Überlappung mit Orbitalen anderer Atome entstehen mit gepaarten Elektronen besetzte Molekülorbitale (sigma-Bindung, Einfachbindung). Durch die Gleichwertigkeit der hybridisierten bindenden Atomorbitale sind auch die Winkel zwischen den Atomen des Moleküls festgelegt: vier gleiche Orbitale müssen bei gleichem räumlichen Abstand zueinander zwangsläufig in die Ecken eines Tetraeders zeigen. Daraus ergeben sich für symmetrische Kohlenstoffverbindungen Bindungswinkel von 109,5º.
Aus dieser Tatsache folgt, daß "lineare" Kohlenstoffketten allenfalls eine Zickzackform mit eben dem Tetraederwinkel zwischen den Atomen haben.
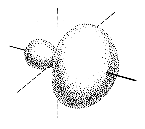
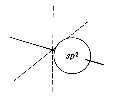
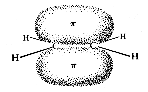
Etwas komplizierter sind die Verhältnisse bei Doppelbindungen zwischen einem Kohlenstoffatom und einem anderen (mindestens zweiwertigen) Atom. In diesem Fall wird eine sigma-Bindung durch eine pi-Bindung ergänzt. Die pi-Bindung entsteht durch Überlagerung von z. B. 2pz-Orbitalen der beteiligten Atome. Dazu müssen die Valenzelektronen des Kohlenstoffs anders hybridisiert werden, nämlich zu sp2:
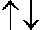 |
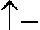 |
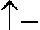 |
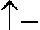 |
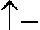 | |
| 1s | 2sp2 | 2pz | |||
 |
 |
 |
| ein sp2-Orbital | pi-Orbitale in Äthen | |
Die drei sp2-Orbitale zeigen bei gleichmäßig größtmöglichen Abständen zueinander in die Ecken eines gleichseitigen Dreiecks, liegen also in einer Ebene. Das einzelne 2p-Orbital steht senkrecht dazu. Wenn von einem Kohlenstoffatom eine Doppelbindung ausgeht, ist der Bindungswinkel daher 120º, die drei Liganden liegen in einer Ebene.
Für Dreifachbindungen oder von einem Kohlenstoffatom ausgehende zwei Doppelbindungen gibt es analog zum vorstehenden die Elektronenkonfiguration 1s2 sp2 2py1 2pz1. In solchen Verbindungen sind die Liganden linear angeordnet.
Im Gegensatz zu Einfachbindungen sind Mehrfachbindungen starr: um die Bindungsachse ist keine Rotation der Molekülteile möglich. An Doppelbindungen gibt es daher eine cis/trans-Isomerie, die isomeren Verbindungen haben unterschiedliche physikalische Eigenschaften:
H3C CH3 \ / C = C / \ H H |
H CH3 \ / C = C / \ H3C H |
| cis-Buten | trans-Buten |
| fp -138ºC, sp 3ºC | fp -105ºC, sp 0ºC |
Die räumliche Ausrichtung im Tetraderwinkel von sp3-hybridisierten Atomen kann zu Besonderheiten führen: Kohlenstoffatome mit vier verschiedenen Liganden sind chiral, d. h. durch Vertauschen zweier Liganden entsteht eine neue Verbindung mit verschiedenen Eigenschaften. Chirale (= händige) Verbindungen sind spiegelbildlich, sie können durch Drehbewegungen nicht zur Deckung gebracht werden. Sie sind nur durch chemische Reaktionen ineinander überführbar.
Ein wichtiges physikalisches Unterscheidungsmerkmal der chiralen Enantiomere ist die Fähigkeit, die Schwingungsebene polarisierten Lichtes in verschiedene Richtungen zu drehen (optisch aktive Substanzen). Die Chiralität hat weitreichende Konsequenzen für die Biochemie, da Enzyme in der Regel nur mit einem Enantiomer reagieren und in komplexen Molekülen mehrere chirale Atome vorkommen können.
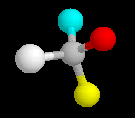
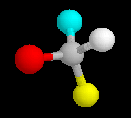
Nomenklatur chiraler Verbindungen:
Die unterschiedlichen Konformationen eines Kohlenstoffatoms werden als R oder S bezeichnet. Dafür gelten folgende Regeln: Zunächst werden die Liganden nach "Wertigkeit" sortiert. Dabei gilt die Stellung im Periodensystem, also z. B. S > O > N > C > H, bei Ketten gleicher Atome ist die längere Kette höherwertig. Dann wird von dem zu charakterisierenden C in Richtung des niedrigwertigsten Liganden geblickt. Sind die anderen drei Liganden in absteigender Wertigkeit im Uhrzeigersinn angeordnet, wird das Kohlenstoffatom mit R bezeichnet, andernfalls mit S. Durch ein (+) oder (-) im Namen kann die (experimentell ermittelte) Drehrichtung von polarisiertem Licht angegeben werden.
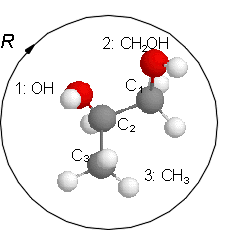
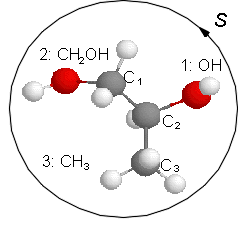
Schreibweise als Strichbild
Zur Einsparung von Druckkosten werden Kohlenwasserstoffketten häufig als Stichbilder dargestellt. Besonders in der Zuckerchemie wird dabei die Fischer-Projektion verwendet. Hierbei wird die Kohlenstoffkette senkrecht angeordnet, wobei das Kohlenstoffatom mit der höchsten Oxidationsstufe nach oben orientiert wird (bei Zuckern das Aldehyd-C = C1). Alle Kohlenstoffatome werden in der Kette so gedreht, daß die senkrechten Bindungen nach hinten zeigen und die waagerechten nach vorne. Die 1,2-Propandiole sehen dann so aus:
H | H - C - OH | H - C - OH | H - C - H | H |
H | H - C - OH | OH - C - H | H - C - H | H |
| (R)-1,2-Propandiol | (S)-1,2-Propandiol |
Eine ältere Nomenklatur zur Bezeichnung chiraler Kohlenwasserstoffe leitet sich von der Fischer-Projektion ab. Hier wird die Ausrichtung auf dem Papier als Bezug genommen: In der (R)-Form des Propandiol oben steht die OH-Gruppe rechts, das Molekül wird mit D (= rechtsstehend) bezeichnet. Die (S)-Form wird entsprechend als L (= linksstehend) bezeichnet. Da hier die Reihenfolge der Kohlenstoffatome auf dem Papier gilt und nicht die Wertigkeit der Liganden, sind beide Bezeichnungen für dasselbe Molekül unabhängig voneinander und nicht unmittelbar ineinander überführbar.
|
|