
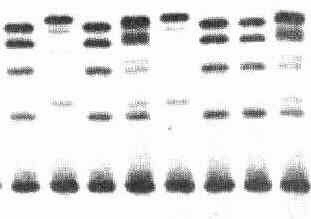
linkes Bild: Isoenzymmuster der Lactatdehydrogenase (LDH) im Herzgewebe embryonaler, juveniler und adulter Mäuse. Die sechs Bahnen zeigen das Muster -9, -5, -1 Tage vor der Geburt sowie +12 ,+21 Tage nach der Geburt sowie in adulten Mäusen. rechtes Bild: Variation der Leucin-Amino-Peptidase (LAP) in Schnecken. Jede Bahn entspricht einer Probe aus je einem Individuum. Das Muster ist individuenspezifisch.
Zur Erinnerung:
Liegt ein Gen in heterozygotem Zustand vor, erhalten wir folglich zwei voneinander verschiedene Polypeptidketten. Unter günstigen Bedingungen können sie gelelektrophoretisch voneinander getrennt werden. Sie können sich auch durch die Substratumsatzraten voneinander unterscheiden; das Genprodukt von a kann beispielsweise inaktiv sein, während das von A voll aktiv ist. Es gibt aber auch alle denkbaren Übergänge dazwischen. Es gibt ferner zahlreiche Beispiele, an denen gezeigt wurde, daß A unter gegebenen Umweltbedingungen vorteilhaft ist, a unter anderen; mehr dazu im Abschnitt Evolution. Polypeptide (Enzyme), die durch unterschiedliche Allele (des gleichen Genorts) codiert werden, nennt man Alloenzyme.
Nun zu den Isoenzymen. Durch Duplikationen des genetischen Materials kann ein Gen im haploiden Genom zwei- oder mehrfach vertreten sein. Es spielt dabei keine Rolle, ob die Genorte auf einem Chromosom liegen oder auf mehrere verteilt sind. Die Genprodukte (hier wieder Enzyme) der verschiedenen Genorte (Pseudoallele) sind die Isoenzyme.
Von einer ganzen Reihe von Enzymen sind Isoenzyme bekannt. Sie können sich durch ihre Umsatzraten und durch ihre Regulierbarkeit voneinander unterscheiden. Ihr Vorkommen ist entweder auf bestimmte Organe oder auf bestimmte Entwicklungsstadien beschränkt.
Das Vorkommen eines Isoenzyms schließt das eines zweiten (oder dritten usw.) nicht aus; oft findet man nur quantitative Verschiebungen im Verhältnis des einen zum anderen. In den verschiedenen Kompartimenten (Plastiden, Mitochondrien, Cytosol) sind in der Regel unterschiedliche Isoenzyme gefunden worden.
Gelelektrophoretisch kann per se nicht zwischen Allo- und Isoenzymen unterschieden werden. Zum Studium von Alloenzymen benötigt man verschiedene Individuen einer Art; es müssen stets gleichartige Zellen miteinander verglichen werden, und man muß so vorgehen, wie bei einer genetischen Analyse mendelnder Faktoren. Zum Nachweis von Isoenzymen genügt im Prinzip ein Individuum, da jedes Individuum einer Art organ- oder entwicklungsstadienspezifisch das gleiche Verteilungsmuster enthält.
Alloenzyme eignen sich als Marker für populationsgenetische Studien, Isoenzyme für entwicklungsphysiologische.
A. Iso- und Alloenzyme der Leucinaminopeptidase des Mais. Die Isoenzymverteilung ist organspezifisch. Die Alloenzyme (in der Abbildung durch Klammern gekennzeichnet) sind Produkte unterschiedlicher Allele (Nach J. L. BREWBAKER, M. D. UPADHYA, Y. MÄKINEN, T. MacDONALD, 1968)
B. Polymorphismus der Peroxydase. Iso- und Alloenzyme beim Mais. Das Isoenzymmuster ist organspezifisch. Die Alloenzyme (in der Abbildung durch Klammern und Ziffern gekennzeichnet) sind Produkte unterschiedlicher Allele (D. E. HAMILL und J. L. BREWBAKER, 1969)
|
|