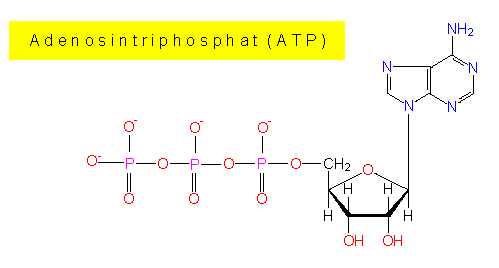
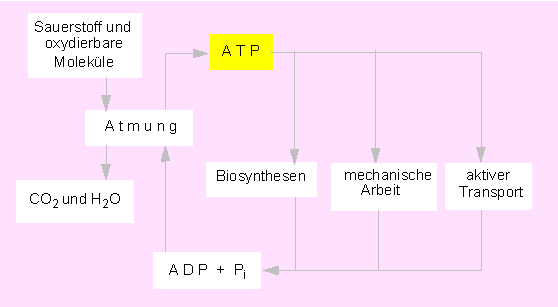
ATP gilt als universeller Energiespeicher und als Energiequelle in Zellen aller Art. Es entsteht zu einem überwiegenden Teil bei der Oxydation energiereicher (reduzierter) Verbindungen als Ergebnis der Umsetzungen in der Atmungskette sowie bei der Photosynthese. Gebraucht wird ATP als
ATP liegt in der Regel als Magnesium- oder Mangan-Salz vor, für die Hydrolyse sind Magnesiumionen erforderlich. Wenn von ATP-Degradation gesprochen wird, meint man durchweg die Hydrolyse der terminalen Phosphatgruppe(n); die Reaktionen sind reversibel:
ATP + H2O < > ADP + H3PO4 (= Pi)
oder
ATP + H2O < > AMP + Pyrophosphat (= PP)
ADP + H2O < > AMP + Pi
ADP und AMP sind die Abkürzungen für Adenosindiphosphat und Adenosinmonophosphat.
Die Phosphate sind untereinander anhydridisch verbunden, zwischen dem innersten Phosphatrest und dem Zuckerrest besteht eine Esterbindung. Die hydrolytische Spaltung ist pH-abhängig. Das delta G° beträgt bei pH 7,0 (unter annähernd physiologischen Bedingungen) -7,3 kcal/mol (ca. -30,6 kJ/mol); es nimmt mit steigendem pH-Wert zu und beträgt z.B. bei pH 9,0 -10 kcal/mol (ca. -42 kJ/mol).
Da die delta Gs für die Abspaltung eines Pyrophosphatrests und eines Phosphatrests nahezu gleich sind, können ATP, ADP und AMP relativ leicht ineinander überführt werden
ATP + AMP < > 2 ADP
Das delta G der ATP-Spaltung ist im Vergleich zur Hydrolyse anderer phosphorylierter Verbindungen keineswegs sehr hoch. Von daher gesehen, ist der Begriff "energiereiche Bindung" irreführend, doch hat er sich in der biochemischen Literatur durchgesetzt, weil die Hydrolyse leicht erfolgt (natürlich unter Enzymmitwirkung) und die Energie tatsächlich zur Verfügung steht. Die Ursache für die leichte Spaltbarkeit beruht auf einer starken Elektronenakkumulation an den terminalen Phosphatresten. Gleichartige (hier negative) Ladungen führen bekanntlich zu elektrostatischen Abstoßungen, die durch Hydrolyse neutralisiert werden.
In vielen Fällen wird der von ATP abgespaltene terminale Phosphatrest nicht als freies anorganisches Phosphat in Lösung entlassen, sondern auf andere Moleküle übertragen, die dadurch phosphoryliert werden. Andererseits kann eine phosphorylierte Verbindung mit einem delta G° > -8 kcal/mol ( -34 kJ/mol) seinen Phosphatrest auch auf ADP übertragen und es somit in ATP überführen.
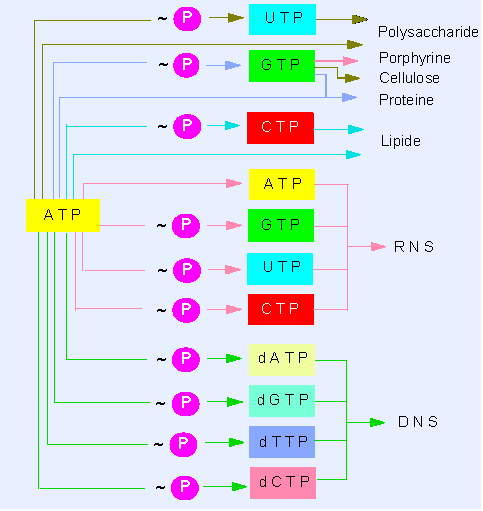
Außer den Adenosinnukleotidphosphaten kommen die Uracil-, Cytosin- und Guaninphosphate vor:
UMP, UDP, UTP, CMP, CDP, CTP, GMP, GDP, GTP.
Die Triphosphatnukleoside der genannten Verbindungen, einschließlich
des ATP, sind Bestandteile von RNS. Ins Polymer werden sie unter Pyrophosphat-
(= PP)-Abspaltung eingebaut. Entsprechende Desoxyribose-Derivate (dATP, dGTP, dCTP....) werden
zur DNS-Synthese benötigt, wobei allerdings anstelle von dUTP dTTP
Verwendung findet. Die terminalen Phosphatgruppen aller Nukleosiddi- und
triphosphate sind gleichermaßen energiereich. Auch die bei ihrer
Spaltung freiwerdende Energie wird für Biosynthesen verwertet. Dabei
stellte sich eine wichtige Arbeitsteilung heraus. UTP wird zur Synthese
von Polysacchariden, CTP zur Synthese von Lipiden und GTP zur Synthese
von Proteinen u.a. benötigt. Die Differenzen beruhen auf unterschiedlicher
Selektivität der Enzyme, die jeden der Stoffwechselwege steuern.
|
|