Es wurden Methoden der in vitro Befruchtung mit isolierten Gameten höherer Pflanzen entwickelt. Zygoten, Embryonen und fertile Pflanzen können nach individueller Fusion von Sperma- und Eizelle erhalten werden. Dies ermöglicht die Untersuchung insbesondere früher Entwicklungsprozesse nach der Befruchtung unabhängig vom mütterlichen Gewebe. Damit haben diese Techniken Bedeutung für die pflanzliche Entwicklungsbiologie. Sie erlauben auch, gametenspezifische- und durch Befruchtung induzierte Gene zu isolieren, Interaktionen der Gameten zu untersuchen und gametische Hybridisierung durchzuführen. Damit sind neue Wege in der Grundlagen- und angewandten Forschung aufgezeigt.
Für die Erarbeitung von Experimentalsystemen zur in vitro Befruchtung mit einzelnen Gameten höherer Pflanzen ist insbesondere der Umstand von Bedeutung, daß die Gameten isoliert werden müssen. Das Nuzellusgewebe, welches den Embryosack umschließt, ist zu entfernen, die Eizelle ist von den nicht-gametischen Zellen des Embryosacks zu trennen. Die Spermazellen müssen aus Pollenkörnern, bei binucleaten Pollenkörnern aus deren Schläuchen isoliert werden. Bei der Befruchtung von Angiospermen fusioniert eine Spermazelle mit der Eizelle und die zweite Spermazelle mit der Zentralzelle (doppelte Befruchtung). Aus dem ersten Fusionsprodukt, der Zygote, entwickelt sich der Embryo, aus dem zweiten das Endosperm. Die zur Befruchtung führenden Prozesse unterscheiden sich somit bei Tieren und Pflanzen beträchtlich.
Methoden der in vitro Befruchtung bei Tieren und niederen Pflanzen haben eine leichte Gewinnung einer hohen Zahl von Gameten gemeinsam. Diese liegen in natürlicher Umgebung frei vor. Aus diesem Grunde wurde bisher ausschließlich mit derartigen Systemen gearbeitet. In vitro Studien zur Befruchtung und Embryogenese werden insbesondere mit Gameten von Seeigeln (z.B. Paracentotus), Braunalgen (z.B. Fucus), Fröschen (z.B. Xenopus), Fischen (z.B. Brachydanio) sowie menschlichen Gameten durchgeführt. Beim Seeigel geschieht die Befruchtung extern. In vitro Befruchtung kann leicht in Seewasser durchgeführt werden. Bei den Säugetieren findet die Befruchtung im oviductalen Lumen, einem komplexen Medium von nicht bekannter Zusammensetzung der Bestandteile, statt. Sie kann ebenfalls in vitro, verbunden mit einer Embryobildung, durchgeführt werden. Bei Säugetieren sind Prozesse der Sperma-Kapazitation notwendig, die es ermöglichen, daß Spermatozoa das Ei befruchten können. Spermatozoa von Säugetieren können auch in vitro kapazitiert werden. Die Befruchtung schließt eine Reihe von Interaktionen zwischen Sperma und Eizelle, von Erkennungs- und Bindungsmechanismen bis zur Fusion der Gameten ein. Werden Säugetiergameten im Reagenzglas miteinander in Kontakt gebracht, so kommt das Spermium zunächst mit der Oberfläche der Zona pellucida, einem dicken extrazellulären Glykoproteinmantel, welcher das Ei umschließt, in Berührung. Die Plasmamembran des Spermiumkopfes erkennt und bindet spezifisch an ZP 3, einem der drei Glykoproteine der Zona pellucida (Ref. in KRANZ et al., 1992).
In vitro Bestäubung/Befruchtung wurde bei einer Reihe von Pflanzenarten mit Blütengewebe-Explantaten durchgeführt. Es wurden dabei in vitro Bestäubungen durchgeführt, die zur Befruchtung dieser Blütenexplantate führten. KANTA und Mitarbeitern gelang 1962 erstmalig die in vitro Bestäubung/Befruchtung von Papaver somniferum (L). Die Bestäubung von isolierten Samenanlagen mit reifem Pollen und die Kultivierung der Explantate führten bis zur Entwicklung von reifen Samen. Neuere Erkenntnisse über Befruchtungsereignisse auf zellulärer Ebene konnten insbesondere mit Hilfe der Elektronenmikroskopie an fixiertem Gewebe gewonnen werden. In den letzten Jahren wurden auch Methoden zur Isolierung von Spermazellen und Embryosäcken sowie einzelnen Zellen des Embryosacks (Eizellen, Synergiden und Zentralzellen) von verschiedenen Pflanzenarten erarbeitet. 1989 gelang erstmalig eine in vitro Befruchtung mit einzelnen isolierten Gameten bei höheren Pflanzen (KRANZ et al., 1990, 1991a). Diese wurde durch die Verknüpfung von Methoden der Gametenisolierung mit Techniken der Gewebekultur, insbesondere der Mikromanipulation und Einzelzellkultur sowie deren Weiterentwicklung möglich (KRANZ, 1992). Als Modellobjekt wurde Mais gewählt. Die in vitro Befruchtung wurde mit isolierten Ei- und Spermazellen durchgeführt. Paare von Gameten wurden unter mikroskopischer Kontrolle durch einen elektrischen Puls fusioniert. Für diese Technologie wurde die Einzelzellfusionsmethode verwendet (KOOP und SCHWEIGER, 1985b) und für das Arbeiten mit Gameten modifiziert (Abb. 1, 2 und 3).
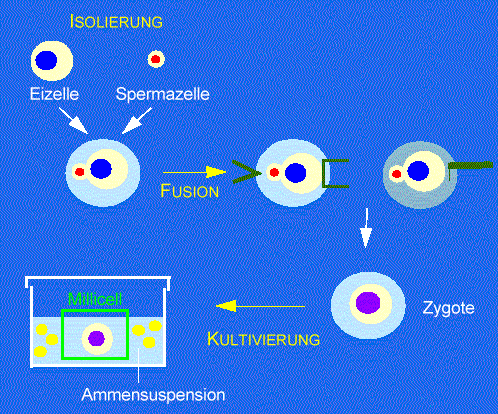
Abb. 1. Methode der in vitro Befruchtung mit einzelnen isolierten Gameten. Sperma- und Eizellen werden isoliert und in Fusionströpfchen übertragen. Paare von Gameten werden fusioniert, entweder nach Anlagerung an einer der beiden Elektroden durch einen elektrischen Puls oder in einem die Zellfusion vermittelndem Medium. Die Fusionsprodukte werden auf semipermeable Membranen eines kleinen Gefäßes (ôMillicellö) übertragen, welches von einer Suspension von Ammenzellen umgeben ist. Nach KRANZ et al., 1991a.

Abb. 2. Anlage zur Isolierung, zum Zelltransfer und zur individuellen Elektrofu-sion von Einzellzellen nach KOOP und SCHWEIGER (1985a,b) und SCHWEIGER et al. (1987) . (1) Inverses Mikroskop; (2) Computer-gesteuerte Mikropumpe; (3) Computer und Monitor; (4) Positionierungssteuergerät; (5) Stromgerät für Mikroskopleuchte; (6) Elektrofusionsgerät; (7) Externes Triggergerät zur Bedi-enung des Elektrofusionsgerätes; (8) Joy-stick zur Bedienung des Schrittmotors; (9) Z-Achse-Schrittmotor. Die Kosten für eine derartige Anlage belaufen sich je nach Ausstattung auf etwa 60 - 80 Tausend DM.
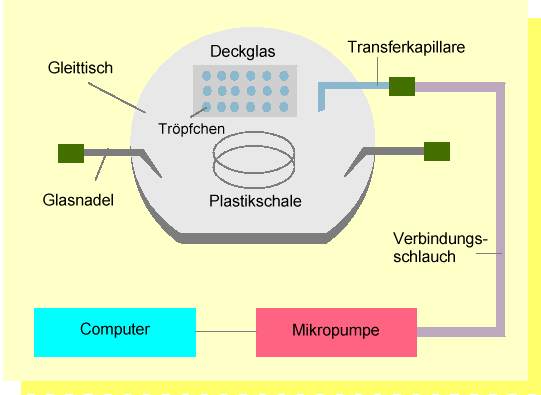
Abb. 3. Anlage zur individuellen Selektion und zum Transfer von Protoplasten des Embryosacks und Spermazellen. Die Arbeitsschritte werden auf einem spe-ziell angefertigten Gleittisch eines inversen Mikroskopes durchgeführt. Eizellen, Synergiden und Zentralzellen werden mit feinen Glas- oder Metallnadeln aus dem Embryosack in einer Isolierungskammer (Plastikschälchen) mechanisch isoliert. Dabei müssen die vorher isolierten Teile des Nuzellusgewebes, welche den Embryosack umgeben, entfernt werden. Oft ist es hilfreich, wie z.B. beim Mais, vor diesem Arbeitsschritt das Nuzellusgewebe mit zellwandabbauenden Enzymen "aufzuweichen". Die Protoplasten werden mittels einer Mikrokapillare, die mit einem hydraulischen System mit einer computergesteuerten Mikropumpe verbunden ist, in Fusionströpfchen, die sich auf einem Deckglas befinden, transportiert. Die Selektion der Spermazellen, die nach dem Platzen der Pollenkörner frei vorliegen, geschieht anschließend ebenfalls in einem Plastikschälchen. Spermazellen werden in die Fusionströpfchen überführt, in denen sich bereits Eizellen befinden. Nach der Fusion werden die Fusionsprodukte in "Millicell"-Einsätze, die sich in Kulturschälchen (Plastikschälchen) befinden, zur weiteren Kultivierung überführt. Dies geschieht, ebenfalls unter mikroskopischer Kontrolle, auf einem Gleittisch.
Kernfusionen konnten reproduzierbar in den Fusionsprodukten nachgewiesen werden (FAURE et al., 1993). Die Zygoten teilten sich mit hoher Frequenz und entwickelten sich zu multizellulären Strukturen, Embryonen und schließlich zu fertilen Pflanzen. Die Hybridnatur der regenerierten Pflanzen und damit eine tatsächlich erfolgte in vitro Befruchtung wurde nachgewiesen (KRANZ und LÖRZ, 1993). Übersichten zur in vitro Bestäubung und Befruchtung beinhalten die Artikel von FAURE et al. (1994b), DUMAS und FAURE (1995) und KRANZ und DRESSELHAUS (1996).
Methoden zur Isolierung von Embryosäcken und Spermazellen sind für eine Vielzahl verschiedener Arten beschrieben worden (Ref. in THEUNIS et al., 1991; DUMAS und RUSSELL, 1992). Die Isolierung einer größeren Anzahl von Eizellen wurde bei einigen wenigen Pflanzenarten erreicht, z.B. Mais (KRANZ et al., 1991a,b), Gerste (HOLM et al., 1994), Weizen (HOLM et al., 1994; KOVÁCS et al., 1994), Deutsches Weidelgras (Van der MAAS et al., 1993).
Maispollen wird von frisch geöffneten Antheren gesammelt und sofort verwendet oder für einige Stunden in feuchter Atmosphäre gelagert (KRANZ und LÖRZ, 1990). Spermazellen werden aus diesen Pollenkörnern nach Platzen durch osmotischen Schock erhalten. Spermazellen sind natürlich vorkommende Protoplasten, die ohne Enzymbehandlung leicht aus reifen, trinucleaten Pollenkörnern isoliert werden können. Um Embryosäcke isolieren zu können, müssen zunächst die Samenanlagen aus der Blüte herausgelöst werden. Für die Isolierung der Embryosäcke sowie deren Eizellen, Synergiden und Zentralzellen aus den Samenanlagen ist eine Enzymbehandlung (mit Pektinase, Pektolyase, Hemizellulase und Zellulase) des den Embryosack umgebenden Nuzellusgewebes bei Mais hilfreich (Abb. 4-6).
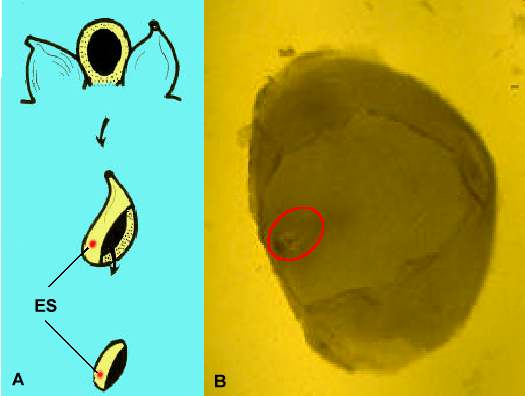
Abb. 4. Methoden zur Isolierung von Embryosäcken von Mais. ES = Embryosack. A: Isolierung von ovularen Gewebestücken aus einem unbefruchteten Maiskolben. B: Embryosackenthaltendes (rotes Oval) ovulares Gewebestück nach Enzymbehandlung.
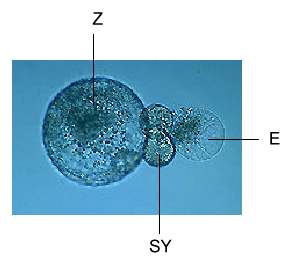
Abb. 5. Isolierte Einheit der Protoplasten von Eizelle (E), zwei Synergiden (SY) und Zentralzelle (Z) von Mais.
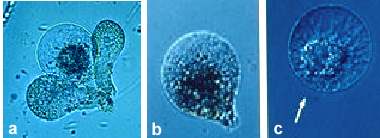
Abb. 6. Isolierte Eizellen von Mais. (a): Zelle mit zwei anliegenden Synergiden. (b): Birnenförmige Zelle kurz nach der Isolierung. (c): Abgerundeter Protoplast. Pfeil zeigt den mikropylaren Pol der Zelle. (Aus KRANZ et al., 1995).
Niedrige Enzymkonzentrationen sowie kurze Inkubationszeiten (etwa 30 Minuten) erwiesen sich zur Vermeidung spontaner Fusionen der Eizellen mit nicht-gametischen Zellen der Embryosäcke als entscheidend. Die Isolierung erfolgt nach der Enzymbehandlung, einem "Aufweichen" des Nuzellusgewebes, mechanisch mittels kleiner Glasnadeln. Spermazellen, Eizellen sowie nicht-gametische Zellen des Embryosacks werden nach erfolgter Isolierung mittels Mikrokapillaren selektiert und durch ein hydraulisches computergesteuertes Pumpsystem in kleine Fusionstropfen übertragen (KOOP und SCHWEIGER, 1985a; Abb. 3).
Bezogen auf die Anzahl der isolierten, Embryosack-enthaltenden Gewebestücke der Samenanlagen, können bis zu 50% isolierte Eizellen erhalten werden. Routinemäßig können etwa 5 Eizellen aus 20 ovularen Gewebestücken isoliert werden (mittlere Isolierungsfrequenz 25%). Dies entspricht etwa 15 - 20 Eizellen/2 Std/geübter Bearbeiter. Eizellprotoplasten von Gerste, Weizen und Mais können auch ohne vorherige Enzymbehandlung rein mechanisch isoliert werden (HOLM et al., 1994; KOVÁCS et al., 1994; KRANZ et al., 1995). Dies deuted darauf hin, daß die Zellwand, die in vivo insbesondere den mikropylaren Bereich der Eizelle umgibt, nicht fest mit dieser Zelle verbunden ist.
Isolierte Sperma- und Eizellen sind Protoplasten. Sie können daher mit den für somatische Protoplasten üblichen Methoden, wie zum Beispiel Elektrofusion, PEG- oder Kalzium- vermittelter Fusion, fusioniert werden. Die Bedingungen, die allgemein zur elektrischen Fusion von somatischen Protoplasten eingesetzt werden, können ebenso zur Fusion von gametischen Zellen Anwendung finden (KRANZ et al. 1990; 1991a,b). Es wurde die elektrische Einzelzell-Fusionsmethode für somatische Protoplasten verwendet (KOOP und SCHWEIGER, 1985b; SCHWEIGER et al., 1987; SPANGENBERG und KOOP, 1992; Abb. 7).
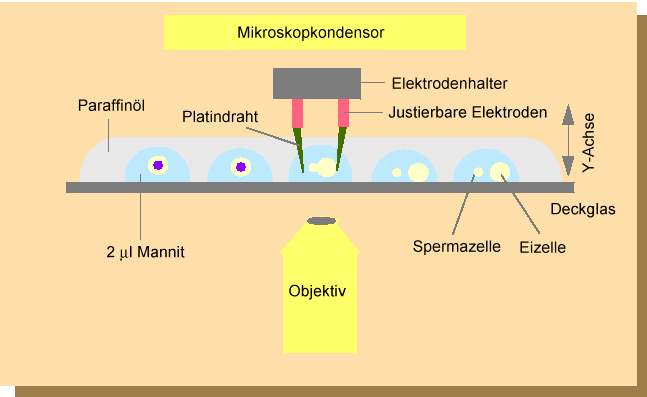
Abb. 7. Anlage zur elektrischen Fusion individueller Ei- und Spermazellprotoplasten. Nach SCHWEIGER et al., 1987, modifiziert.
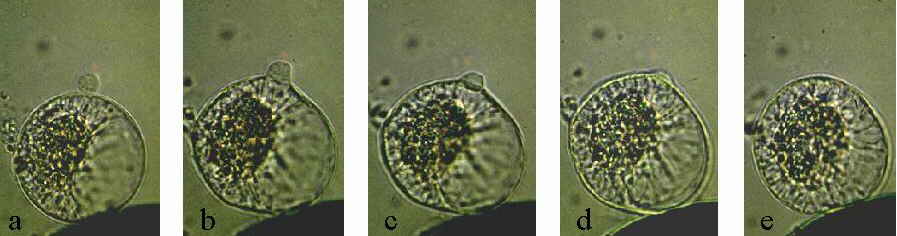
Abb. 8A. Elektrofusion. Das Zeitintervall nach Gabe eines einzelnen Gleichspannungspulses von (a)-(d) betrug 3 Sekunden. Normalerweise ist die Zellfusion schon nach weniger als einer Sekunde abgeschlossen.
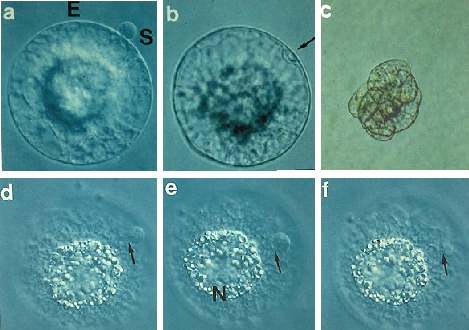
Abb. 8B. Chemische Fusion. Adhäsion und Fusion in einem Medium mit Kalziumchlorid (0,05M CaCl2 ) und einem pH-Wert von 11 und Entwicklung des Fusionsproduktes zu einer multizellulären Struktur. (a): Zelladhäsion des Ei- und des Spermazellprotoplasten (S). Balken = 10 Ám 5 Tage nach Gametenfusion. Balken = 50 Ám. Nach einer Adhäsionszeit von 10-20 Minuten betrug das Zeitintervall von (d)-(f) 2 Sekunden. Im allgemeinen ist die Zellfusion in weniger als einer Sekunde abgeschlossen. N = Nukleolus im Eikern sichtbar. Pfeile zeigen den Ort der Zellfusion an. Balken: 10 Ám. Die Abbildungen (a)-(b) und (d)-(f) zeigen Fusionen von zwei unterschiedlichen Paaren von Ei- und Spermazellprotoplasten. KRANZ und LÖRZ, 1994 .
Spermazellen besitzen ein sehr hohes Fusionspotential. Die mittlere Fusionsfrequenz von einzelnen Spermazellen beträgt 85% (KRANZ et al., 1991b). Diese hohe Fusionsrate kann auch bei der Fusion von Spermazellen mit Eizellen festgestellt werden (KRANZ et al., 1990, 1991a; Abb. 8a). Spindelförmige Spermazellen fusionieren nach Pulsgabe effizienter mit Eizellen als abgerundete Spermazellen. Dabei fusioniert zunächst eines der Fädchen der Spermazelle mit der Eizelle. Anschließend kommt es zur Aufnahme des Hauptteils der Spermazelle einschließlich des zweiten Fädchens in die Eizelle (Abb. 8C).
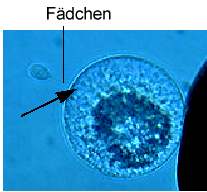
Abb. 8C. Dielektrophoretische Anlagerung eines nach Isolierung der spindelförmigen Spermazelle noch bestehenden, typischen Fadens an die Eizellmembran. Pfeil zeigt den Fusionsort. Balken = 25 Ám. KRANZ et al., 1995.
Ob diese Art der Gametenfusion in vivo geschieht oder ob abgerundete Spermazellen mit der Eizelle bzw. mit der Zentralzelle fusionieren, ist unbekannt.
Die Fusion der Gameten kann auch mit Kalzium erzielt werden (KRANZ, 1993; KRANZ und LÖRZ, 1994; FAURE et al., 1994a; Abb. 8B). Bei dieser chemisch vermittelten Fusion können Interaktionen der Gameten, wie z. B. Adhäsion, Zellfusion und mögliche Erkennungsmechanismen, untersucht werden. Fusionen von Paaren von jeweils einem Ei- und einem Spermazellprotoplast können unter mikroskopischer Kontrolle beobachtet werden, nachdem sie in einem Medium mit Kalziumchlorid (0,05M CaCl2), Mannit (400 mosmol/kg H2O) und einem pH Wert von 11,0 mittels einer feinen Glasnadel in Kontakt gebracht wurden (Abb. 1; 8B). Nach erfolgter Adhäsion der Gameten dauert es in der Regel noch etwa 20 Minuten, bis die Gameten fusionieren. Die Zellfusion geschieht dann, vergleichbar mit der elektrischen Fusion, sehr schnell. Sie ist in weniger als einer Sekunde abgeschlossen (KRANZ und LÖRZ, 1994). Die Geschwindigkeit der Zellfusion dürfte von der unterschiedlichen Größe der Zellen abhängig sein. Bei Mais beträgt der mittlere Durchmesser der isolierten Spermazelle 7 Ám und derjenige der reifen, isolierten Eizelle erreicht 77 Ám (KRANZ et al., 1995). Spontane Fusion zweier Eizellen kann gelegentlich in Mannitlösung ohne Dielektrophorese beobachtet werden. In Ca++- enthaltenden Medien wurden gelegentlich Fusionen von Paaren von Eizell- als auch von Spermaprotoplasten beobachtet. Es bleibt zu klären, ob die Gametenfusion bei höheren Pflanzen rezeptorvermittelt oder nicht-gametenspezifisch geschieht, vergleichbar mit der Fusion somatischer Zellen, z. B. in Anwesenheit von Ca++ und bei hohem pH-Wert (KELLER und MELCHERS, 1973). Die elektrisch vermittelte Gametenfusion ist sehr effizient. Die chemische Fusion der Gameten mittels Kalzium ist zu optimieren, insbesondere die mechanische Prozedur des Aneinanderreihens der beiden Gameten vor der Fusion.
Zellteilungen von Zygoten nach in vitro Fusion von Ei- und Spermazellen wurden bisher nur bei Mais und Weizen beschrieben: In vitro Zygotenentwicklung bei Mais nach Elektrofusion der Gameten (KRANZ et al., 1990; KRANZ et al., 1991a,b), später von in vitro Zygoten nach chemischer, durch Kalzium induzierte Fusion (KRANZ 1993; KRANZ und LÖRZ, 1994) und Weizen (Elektrofusion, KOVÁCS et al., 1995). Auf Grund des limitierten Ertrages an Fusionsprodukten mußte ein Einzelzellkultursystem verwendet werden, welches in der Lage ist, dauerhaftes Wachstum der Zygoten zu garantieren. Dafür wurde ein "Millicell/Ammensuspension"- System entwickelt. Die Qualität der Zellen der Ammensuspension ist dabei von grundlegender Bedeutung. Bei Mais eigneten sich nur Zellaggregate, bestehend aus kleinen zytoplasmareichen und wenig Stärkekörner enthaltenden Zellen. Ausschließlich diese nachfolgend beschriebene Methode garantierte dauerhaftes Wachstum der Zygoten, verbunden mit einem hohen Ertrag an relativ großen Strukturen (etwa 0,5 mm). Nur Strukturen dieser Größe konnten sich nach Übertragung auf Festmedium weiterentwickeln und Pflanzen regenerieren.
Nach erfolgter Fusion wurden die Zygoten individuell mittels einer Kapillare in "Millicell-CM" - Einsätze mit semipermeablen transparenten Membranen überführt und kultiviert. Diese Einsätze wurden in der Mitte von Plastikschälchen plaziert, in die vorher eine Maissuspension zugegeben wurde (Abb. 1). Diese nicht-morphogene Zellsuspension von Mais, von isolierten zygotischen Embryonen etabliert, wurde als Ammenkultur verwendet. Sowohl die Fusionsprodukte als auch die Ammenzellen wurden in modifiziertem Murashige und Skoog-Medium (MURASHIGE und SKOOG, 1962) mit Dichlorphenoxyessigsäure (2,4-D) sowie Glukose auf einem Schüttler kultiviert. Auch aus isolierten, in vivo befruchteten Gerste- und Weizeneizellen konnten fertile Pflanzen regeneriert werden. Diese in vivo Zygoten wurden während ihrer frühen Entwicklungsphase ebenfalls mit Ammenzellen (isolierte Mikrosporen) kultiviert (HOLM et al.,1994).
Zygotische Polarität führt zu der entwicklungsbiologisch bedeutsamen Trennung in Embryo und Suspensor. Diese scheint auf die ungleiche Verteilung des Zytoplasmas in der Eizelle zurückzuführen zu sein (Ref. in REISER und FISCHER, 1993; WEST und HARADA, 1993; GOLDBERG et al., 1994). Obwohl sich die Eizelle nach deren Isolation abrundet, bleibt die Polarität dieser Zelle erkennbar. Die Plastiden mit Stärkekörnern und die Mitochondrien sind hauptsächlich um den Kern gelagert (Abb.9, 10, 11).
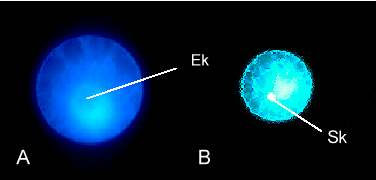
Abb. 9. Epifluoreszenz-Aufnahmen einer isolierten unbefruchteten (A) und einer in vitro befruchteten (B) Mais-Eizelle nach 4',6-Diamidino-2-phenylindol (DAPI)-Färbung. (A) Während der Kern (Ek) kaum Färbung erkennen läßt, sind die um den Kern gelagerten Organellen stark angefärbt. (B) Der Kern der Spermazelle befindet sich in der Eizelle (20 Minuten nach Zellfusion). Die starke Anfärbung des Spermakerns (Sk) deutet auf kondensiertes Chromatin hin. Mit Genehmigung aus KRANZ et al., 1991; 1995.

Abb. 10. Transmissionselektronenmikroskopische Aufnahme einer isolierten Mais-Eizelle. Die Organellen sind vorwiegend um den Kern gelagert. PM = Plasmamembran, V = Vakuole, N = Kern, Nu = Nukleolus, P = Plastid mit Stärkekorn. Balken = 5 Ám. FAURE et al., 1992.
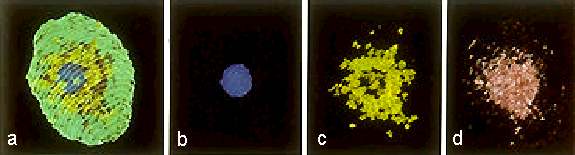
Abb. 11. Rekonstruktion der Organisation einer isolierten Eizelle von Mais und die Verteilung ihrer Organellen. (a): Gesamtbild des Protoplasten, Plasmamembran = weiße Linien, (b): Kern = blau, (c): Plastiden = gelb-grün, (d): Mitochondrien = rot. FAURE et al., 1992.
Diese Ansammlung von Organellen ist nicht zentral in der Eizelle lokalisiert. Interessanterweise bildet die isolierte Eizelle neues Zellwandmaterial in Kultur nur lokal, an einem Pol der Zelle (KRANZ et al., 1995). Hinsichtlich der Zellwandbildung stellt sie ihre Polarität in Kultur wieder her (Abb. 21c,e,f). Diese Beobachtung ist mit der in vivo Situation vergleichbar, bei der generell die Eizelle von der Zellwand nur am mikropylaren Pol umgeben wird. Die Zellwandneubildung der Zygote geschieht sehr schnell. Sie ist bereits 30 Sekunden nach der Gametenfusion mit Calcofluor nachweisbar und kann als ein Mechanismus zur Verhinderung von Polyspermie gesehen werden (KRANZ et al., 1995). Nach der Vereinigung von Sperma- und Eizelle wandert der Spermakern innerhalb von 20 Minuten bis zum Eizellkern. Beide Kerne haben sich etwa 20 bis 45 Minuten nach Gametenfusion aneinander gelagert und fusionieren miteinander, 35 Minuten (TIRLAPUR et al., 1995), in der Regel zwischen 45 und 60 Minuten nach Zellfusion (FAURE et al., 1993). Die Karyogamie wird durch die Abbildungen 12 und 13 belegt. Die Beobachtung der Kernfusion ist durch die Heterogenität des Chromatins der beiden Kernstrukturen möglich.
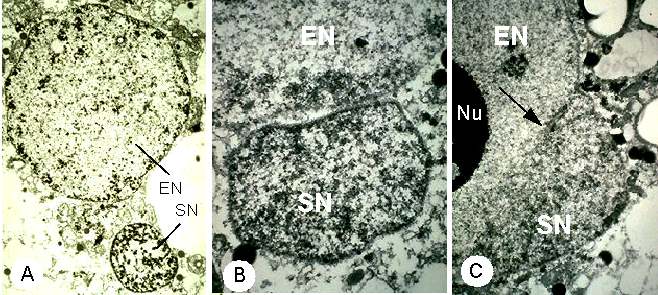
Abb. 12. Elektronenmikroskopische Aufnahmen der Kernfusion nach in vitro Gametenfusion bei Mais. A: Fusionsprodukt 105 Minuten nach Gametenfusion mit Spermakern (SN) und Eizellkern (EN). B: Der Spermakern (SN) hat sich an den Eizellkern (EN) angelagert. Das Fusionsprodukt wurde 21 Minuten nach Elektrofusion der isolierter Gameten fixiert. C: Fusion des Sperma- (siehe Pfeil) mit dem Eizellkern (EN) nach Elektrofusion isolierter Gameten. Das Fusionsprodukt wurde 58 Minuten nach Zellfusion fixiert. Nu = Nukleolus. FAURE et al., 1993.
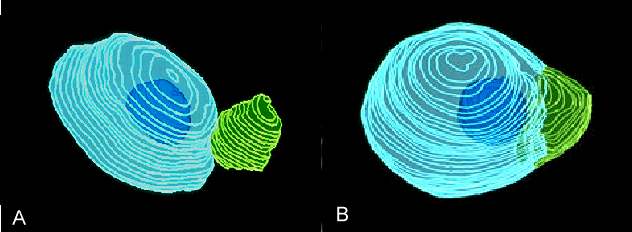
Abb. 13. Rekonstruierte Kerne in Fusionsprodukten von Mais. Spermakern = grün, Eikern = hellblau, Nukleolus des Eikerns = dunkelblau. A: Anlagerung der Kerne 21 Minuten nach Elektrofusion. B: Beide Kerne sind 58 Minuten nach Elektrofusion fusioniert. Das väterliche Chromatin ist noch zu erkennen. FAURE et al., 1993 .
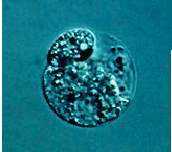
Wie in vivo sind auch die in vitro Zygoten polar. Die Kerne befinden sich an der Zellperipherie (Abb. 14). Die Bildung eines zweiten Nukleolus ist nach 18 Stunden nach Gametenfusion beobachtet worden (Abb. 15). Die erste Zellteilung verläuft inäqual und resultiert in einer kleinen, zytoplasmareichen Zelle und einer größeren, vakuolisierten Zelle (Abb. 16g, Bild rechts). Während sich isolierte Eizellen nicht teilen, beginnen sich die Zygoten unter vergleichbaren Kultivierungsbedingungen 30 Stunden, generell 42 bis 46 Stunden nach Gametenfusion zu teilen (KRANZ und LÖRZ, 1993; KRANZ et al., 1995; Abb. 17). Verglichen mit der Größe der in vitro Zygote (mittlerer Durchmesser 65 Ám, ein Tag in Kultur), sind die Zellen der multizellulären Strukturen wesentlich kleiner (mittlerer Durchmesser 12,5 Ám, 6 Tage in Kultur). Die Beobachtung der Abnahme der Zellgröße ist ebenfalls in vivo während der frühen Entwicklung von Embryonen u.a. Gossypium, Hordeum und Oryza gefunden worden. Die mittlere Frequenz der ersten Teilung und Mikrokallus-Entwicklung betrug 85%, basierend auf etwa 3000 kultivierten Fusionsprodukten. Hohe Raten der Bildung von multizellulären Strukturen konnten ebenso bei Fusion von Ei- und Spermazellen verschiedener Maislinien festgestellt werden.
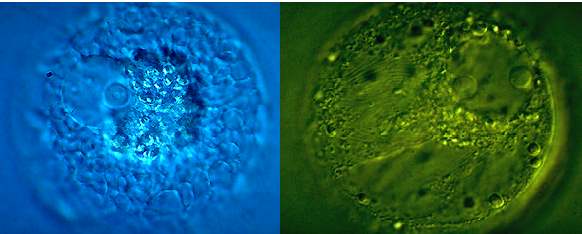
Abb. 14. Mais-Zygote, 15 Stunden nach Fusion von Ei- und Spermazelle. Nukleolus im Kern (N) sichtbar. KRANZ et al., 1995.
Abb. 15. Zwei Nukleoli im peripher gelegenen Kern der Mais-Zygote, 40 Stunden nach Fusion von Ei- und Spermazelle. KRANZ et al., 1995.
Während der Entwicklung der multizellulären Strukturen erscheinen die Ebenen der Zellteilungen irregulär (Abb 16: 16h, links). Dies ist auch beim Mais in situ zu beobachten. Innerhalb von 10 - 12 Tagen nach der Gametenfusion kann jedoch wieder eine bilaterale Symmetrie beobachtet werden (Abb. 16,17). Die globulären Strukturen entwickeln sich zu länglichen Strukturen. Der meristematische Teil ist weiter vergrößert, charakteristisch für das Koleoptilen-Stadium. Der eine Bereich dieser polarisierten Strukturen besteht aus kleinen, zytoplasmatisch reichen Zellen, während der andere Teil aus größeren, vakuolisierten Zellen besteht. Diese größeren Zellen bilden den länglichen Bereich der Strukturen, den Suspensor (Abb. 16i).
Die meristematische Region wird oft von einer äußeren Zellschicht begrenzt, die als Protoderm gedeuted werden kann. Die Entwicklung in vitro ist somit mit derjenigen des frühen zygotischen Embryos in vivo vergleichbar. Die Embryonen vergrößern sich weiter nach Transfer auf ein Festmedium und entwickeln sich zu Strukturen, die aus weißem, kompaktem Kallus bestehen. Aus diesen entwickeln sich Koleoptilen (Abb. 16k). Pflanzenregeneration ereignete sich sowohl über primäre und sekundäre Embryogenese als auch über Organogenese. In einigen Fällen entwickelten sich mehrere Pflanzen aus einem Proembryo. Morphologisch ähnelt die weitere Entwicklung der in vitro erzeugten Transitions-Phase-Embryonen, insbesondere das "Auswachsen" des Scutellums und die in einigen Experimenten beobachtete Polyembryonie der somatischen Embryogenese (Abb. 16k). Die bipolaren Embryoide entwickelten sich rasch zu Pflänzchen, so daß innerhalb von 5-6 Wochen nach Gametenfusion grüne, phänotypisch normale Pflanzen entstanden (Abb. 16 l, m), die nach weiteren 10 Tagen in Erde und in das Gewächshaus überführt werden konnten. Von 28 Fusionsprodukten aus 4 unabhängigen Experimenten konnten 11 Pflanzen regeneriert werden (Regenerationsfrequenz von 48%).
Im Vergleich zur (nach wie vor schwierigen) Pflanzenregeneration aus somatischen Getreideprotoplasten ist diese Regenerationsrate sehr hoch. Die regenerierten Pflanzen wurden 99 - 171 Tage nach der Gametenfusion selbstbestäubt (Abb. 16a, 17). Die Kolben mit den reifen Samen wurden 148 - 215 Tage nach Fusion geerntet (Abb. 17, 18). Während die erste Zellteilung der in vitro Zygote im Vergleich zur in vivo Situation verzögert auftritt, ist die frühe Embryogenese in vitro und in vivo etwa zeitgleich. Pflanzen können nach in vitro Befruchtung schneller erhalten werden, da eine Embryoreifung entfällt (Abb. 17). Die Samen dieser Pflanzen bestanden aus normal entwickelten Embryonen und Endosperm. Sie keimten und entwickelten sich zu phänotypisch normalen F2 Pflanzen. Der Prozeß der Embryobildung nach erfolgter in vitro Gametenfusion ist als in vitro zygotische Embryogenese zu bezeichnen und von somatischer Embryogenese zu unterscheiden.
Der diploide Satz von 2n = 20 Chromosomen wurde in den Wurzelspitzen aller Fusionspflanzen beobachtet. Die Körnerfärbung der Linie A188 ist weißlich, diejenige der Linie Pirat gelb bis dunkelgelb. Die Körner des Kolbens von Hybridpflanzen sind dunkelgelb, hellgelb oder weiß (Abb. 18).

Abb. 18. Kolben der Eizellen- (A188), links) und der Pollenspenderpflanze (Pirat, rechts) sowie einer Fusionspflanze (Mitte).
Eine signifikante 3 : 1 Spaltung der Körnerfarbe von gelb und weiß der geselbsteten Fusionspflanzen bestätigt die Hybridnatur der Fusionspflanzen. Der Zyklus von der Isolierung einzelner Gameten, deren Fusion zu Zygoten, der Bildung polarer Embryonen bis zur Regeneration von fertilen Pflanzen konnte somit geschlossen werden (KRANZ und LÖRZ, 1993; Abb. 16). Die Reife dieser Embryonen sollte durch eine Optimierung der in vitro Bedingungen, insbesondere durch Anwendung von Reifungsmedien möglich sein.
Die Regeneration fertiler Pflanzen gelang auch aus in vivo befruchteten und anschließend isolierten Gerste- und Weizen-Eizellen (HOLM et al., 1994) sowie aus isolierten Embryosäcken (mit anhaftendem Nuzellusgewebe), die ebenfalls in vivo befruchtet wurden (CAMPENOT et al., 1992; MÓL et al., 1993).
Der Pollen der regenerierten Pflanzen war phänotypisch normal, und es konnte kein abweichendes Verhalten bei der in vitro- und in vivo Keimung beobachtet werden. In vitro Keimung von Maispollen, bisher in Flüssigmedien durchgeführt, ist auf Grund des häufigen Platzens der Pollen und Pollenschläuche schwierig. Deshalb wurden neue in vitro Keimungsverfahren entwickelt (KRANZ und LÖRZ, 1990; KRANZ und BROWN, 1992). Diese haben gemeinsam, daß nur solch geringe Mengen destilierten Wassers dem Pollenkorn zugeführt werden, die zum Austritt des Pollenschlauches notwendig sind, ein Platzen des Pollenkorns jedoch nicht verursachen. Eine effiziente Keimung konnte mit wasserspendenden Emulsionen erzielt werden. Nach Sichtbarwerden der Pollenschlauchspitze wurden die Feuchtigkeitsverhältnisse stabilisiert, indem die auf einer dünnen Emulsionsschicht befindlichen Pollenkörner mit Mineralöl beschichtet wurden. Durch Anwendung dieser Emulsions-/öltechnik können die frühen Phasen der Bestäubung, die nach der Deposition eines Graspollenkorns auf der Narbe stattfinden, e.g. Hydration, Exudation und Resorption in vitro beobachtet werden. Bei diesen Experimenten wurde ausschließlich destilliertes Wasser verwendet. Zucker und Bor, in den herkömmlichen Pollenkeimungsmedien enthalten, sind nicht notwendigerweise für die Pollenkeimung von Mais (als auch von Gerste und Tabak) erforderlich.
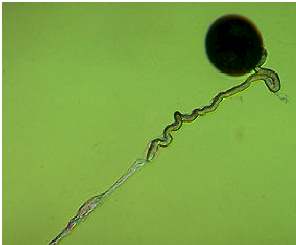
Abb. 19. In vitro Keimung von Mais-Pollen und Pollenschlauchwachstum unter Mineralöl. Der wachsende Pollenschlauch folgt der gelegten Wasserspur ("Hydrotropismus").
Unter den beschriebenen in vitro Keimungsbedingungen zeigen die Pollenschläuche gerichtetes Wachstum in der Art, daß sie in Richtung der Pollenkörner, entlang Wasserkanälen oder befeuchteten Zellulosefasern wachsen (Abb. 19) Da nur destilliertes Wasser verwendet wurde, ist hierbei ein Hydrotropismus anzunehmen, der schon 1869 von VAN TIEGHEM vermutet wurde. Einige Prozesse, die nach erfolgter Bestäubung ablaufen, wie die Entleerung des Inhaltes des Pollenkorns und dessen Verlagerung im wachsenden Pollenschlauch, können bei Mais im lebenden Narbengewebe ohne Anfärbung mikroskopisch leicht sichtbar gemacht werden. Dazu werden Segmente von Narbenfäden (etwa 10 cm lang) bestäubt und etwa 30 min in einer feuchten Kammer belassen. Während dieser Zeit ist der Pollenschlauch bereits in das Narbengewebe eingedrungen. Nun werden 3-4 cm lange Segmente der bestäubten Narbenfäden geschnitten und auf ein Deckglas überführt. Diese Narbenfäden werden mit Mineralöl überschichtet, und die genannten Vorgänge können anschließend unter dem Mikroskop verfolgt werden.
Fusionsprodukte konnten durch Elektrofusion von einzelnen Spermazellen mit einzelnen isolierten Synergiden, Zentralzellen und somatischen Zytoplasten (Protoplasten ohne Zellkern) erhalten werden (KRANZ, et al., 1991b). Es wurden folgende Fusionskombinationen erhalten:
Spermazelle + Synergide;
Spermazelle + Zentralzelle (Die Isolierung der Zentralzelle ist schwierig und daher der limitierende Faktor.);
Spermazelle + Synergide mit anhaftender Eizelle und gelegentlich mit anhaftender zweiter Synergide;
Spermazelle + Eizelle mit anhaftenden Synergiden und gelegentlich mit anhaftender Zentralzelle;
Spermazelle + Zytoplast + Eizelle, gelegentlich mit anhaftenden Synergiden und Zentralzelle (Abb. 20).
Auf Grund der sehr guten Fusionseigenschaften der Spermazellen wurden auch bei diesen Fusionskombinationen regelmäßig hohe Fusionsfrequenzen festgestellt. Diese Fusionsmöglichkeiten können sowohl Untersuchungen der Befruchtungsprozesse als auch der Effekte der nicht-gametischen Zellen auf die Entwicklung der künstlich produzierten Zygoten stimulieren. Fusionsprodukte von Sperma- und Zentralzelle entwickelten sich in Kultur gelegentlich zu größeren Strukturen. Damit ist die Möglichkeit der Erzeugung von Endosperm bei höheren Pflanzen in vitro aufgezeigt (E. KRANZ, unveröffentlicht). Es konnten auch mit Hilfe von Mais-Zytoplasten Chloroplasten und Mitochondrien während der in vitro Befruchtung in die Eizelle bzw. in die Zygote übertragen werden (Abb. 20). Die Vererbung von Chloroplasten geschieht bei den meisten Angiospermen maternal. Aus der Möglichkeit, Plastiden und Mitochondrien unmittelbar mit dem Befruchtungsprozess zu übertragen, ergeben sich neue experimentelle Ansätze zur zytoplasmatischen Vererbung. Zellrekonstitution wurde mittels Fusion einer bzw. zweier Spermazellen mit Zytoplasten durchgeführt. Dabei entstanden neue haploide bzw. diploide Zellen. Die Rekonstitution von Zellen mit unterschiedlichen Ploidiegraden, insbesondere haploiden Zellen, ist nicht nur für wissenschaftliche Fragestellungen, sondern auch für die Züchtung von Interesse, falls es gelänge, Zellinien zu etablieren und Pflanzen aus diesen zu regenerieren.
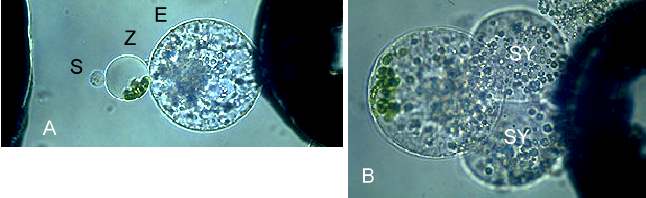
Abb. 20. Übertragung von Organellen mittels Mais-Mesophyllzytoplasten in die Eizelle während der in vitro Befruchtung von Mais. A: Eizelle (E), Zytoplast (Z) und Spermazelle (S) im dielektrischen Feld kurz vor der Pulsgabe. B: Fusionsprodukt aus Eizelle, Zytoplast und Spermazelle mit anhaftenden Synergiden
Unbefruchtete Eizellen und Fusionsprodukte von Eizelle + Eizelle sind in Kultur bis zu 3 Wochen lebensfähig (KRANZ et al., 1991a). Im Gegensatz zu den Zygoten konnten jedoch niemals Zellteilungen beobachtet werden (Abb. 21). Werden Eizellprotoplasten einem hochfrequenten Wechselfeld und Feldpulsen in Abwesenheit von Spermazellen ausgesetzt, so teilen sich diese Zellen auch nicht. Calcofluor white anfärbbare, neugebildete Zellwandbausteine umgeben die kultivierten Eizellen und Fusionsprodukte aus Eizelle + Eizelle, jedoch wird nur eine relativ dünne Zellwandschicht gebildet, die sich beim Transferieren der Zelle leicht ablösen läßt. Die Ausbildung einer Zellwand ist bei diesen Zellen im Vergleich zu den Zygoten gehemmt. Werden kultivierte Eizellen nach einer oder zwei Wochen dem Wachstumsmedium entnommen, so können sie, in Fusionsmedium übertragen, mit einer Spermazelle fusioniert werden. Die Elektrofusion ist möglich, da die Membran freiliegt (Abb. 21f).
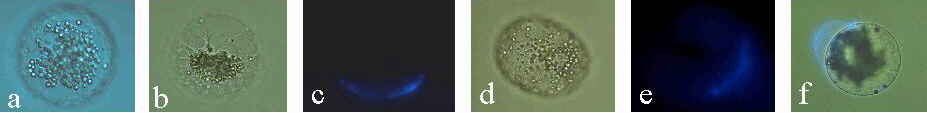
Abb. 21. Kultivierte Mais-Eizellen. (a): Zelle, vier Tage nach Isolation. Die Zellorganellen (Stärkekörner sind sichtbar) sind locker um den Kern gelagert. Der Nukleolus ist sichtbar. (b): Zelle, vier Tage nach Isolation. Die Zellorganellen sind dicht um den Kern gelagert. (c): Epifluoreszenz-Aufnahme zeigt Calcofluor White-positives, neu gebildetes Zellwandmaterial. Nach Zellisolation wurde die Zelle 7 Minuten in Kulturmedium inkubiert und danach angefärbt. Die Bildung der Wandmaterialien erfolgt nicht uniform, sondern in polarer Weise. (d): Zelle, 46 Stunden nach Isolation. (e): Epifluoreszenz- Aufnahme zeigt die polare Anordnung von Calcofluor White-positivem, neu gebildetem Zellwandmaterial. (f): Licht/Epifluoreszenz-Aufnahme einer Zelle, 7 Tage nach Isolierung. Calcofluor White-positives, neu gebildetes Wandmaterial ist nicht fest an der Zellmembran verankert. Mechanische Ablösung der Zellwand vom Protoplasten nach Zelltransfer mittels einer Mikrokapillare. KRANZ et al., 1995.
Die Fusionsprodukte aus vorher kultivierten Eizellen mit Spermazellen teilen sich bei erneuter Kultivierung (KRANZ et al., 1995; Abb. 22a). Eizellaktivierung und Wachstum isolierter, unbefruchteter Mais-Eizellen kann auch durch kurzzeitige Behandlung mit hohen 2,4-D-Gaben erzielt werden (KRANZ et al., 1995; Abb. 22b).
Dieses System eignet sich für eine Reihe von vergleichenden Untersuchungen, u.a. für Studien früher Ereignisse der Signaltransduktion in zum Beispiel Auxin-aktivierter Eizellen mit denjenigen in befruchteten Eizellen. Ferner könnte die erstmalig an isolierten Mais-Eizellen beobachtete induzierte Parthenogenese zur Entwicklung einer Methode genutzt werden, aus unbefruchteten Eizellen haploide Pflanzen für Züchtungszwecke zu erzeugen.
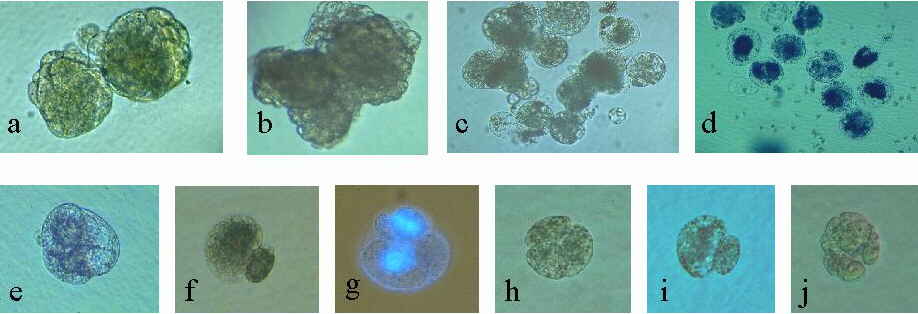
Abb. 22. Induktion der Zellteilung von Mais-Eizellen. Erste Zellteilung und Bildung multizellulärer Strukturen von kultivierten Zellen, gametisch-somatisch homologen und gametisch heterologen Fusionsprodukten. (a): Zwei multizel-luläre Strukturen 15 Tage nach Fusion einer 6 Tage kultivierten Eizelle mit einer Mais-Spermazelle. (b): Sporophytische Entwicklung einer unbefruchteten Eizelle, die nach Isolation für 1 Stunde mit 40 mg/l 2,4-D behandelt wurde. 23 Tage in Kultur. (c): Multizelluläre Struktur, 8 Tage nach Fusion einer Ei- mit einer Coix- Spermazelle. (d): Multizelluläre Struktur, 4 Tage nach Fusion einer Ei- mit einer Sorghum- Spermazelle. (e): Multizelluläre Struktur, 9 Tage nach Fusion einer Eizelle mit einem Mais-Zellsuspensionsprotoplast. (f): Inäquale, erste Zellteilung eines Fusionsproduktes einer Ei- und einer Weizen-Spermazelle, zwei Tage nach Fusion. (g): Licht/Epifluoreszenz-Aufnahme nach Kernfärbung mit DAPI. Fusionsprodukt einer Ei- und einer Weizen-Spermazelle nach der inäqualen, ersten Zellteilung und Teilung der großen Zelle. Pfeile zeigen die Zellwände des Fusionsproduktes und diejenigen der großen Zelle. (h): Multizelluläre Struktur 7 Tage nach Fusion einer Eizelle mit einer Weizen-Spermazelle. (i): Inäquale, erste Zellteilung des Fusionsproduktes einer Eizelle und einer Gersten-Spermazelle, 3 Tage nach Fusion. (j): Multizelluläre Struktur 6 Tage nach Fusion einer Eizelle mit einer Gersten-Spermazelle. KRANZ et al., 1995.
Die hier vorgestellten in vitro Befruchtungstechniken haben insbesondere den Vorteil, Befruchtungsvorgänge und sehr frühe Ereignisse der Zygotenentwicklung unter definierten Bedingungen zu verfolgen, die im in vivo System nur schwer zugänglich sind. Sie ermöglichen z.B. Studien der Gametenerkennung, der befruchtungsinduzierten Signaltransduktion, der Differenzierung von Zygoten ohne den Einfluß von Nachbarzellen, des Einflusses nicht-gametischer Zellen des Embryosacks auf die Zygotenentwicklung sowie der zytoplasmatischen Vererbung.
Neben Studien der somatischen Embryogenese und der Embryogenese aus in vivo befruchteten Eizellen und Embryosäcken kann dieses neue Experimentalsystem mit neuen zellbiologischen und molekularbiologischen Erkenntnissen zum Verständnis der pflanzlichen Embryogenese beitragen. Mit diesen Techniken können die Übergänge von einer Eizelle zur Zygote, zum Embryo und schließlich zur Pflanze unter definierten Bedingungen verfolgt werden. Da die Bedingungen für die Entwicklung von individuellen Embryonen früher Stadien aus definierten, einzelnen in vitro produzierten Zygoten etabliert sind, sind Manipulationen und Studien vieler Aspekte der frühen zygotischen Embryogenese unabhängig von Effekten umliegender Zellen und Geweben möglich geworden. Da bisher keine in vitro Zygoten von einzelen isolierten Gameten höherer Pflanzen erhalten werden konnten, wurde insbesondere das Fucus-System herangezogen, um zu untersuchen, wie diese pflanzliche Eizellen nach der Befruchtung polarisiert werden und wie die Embryoachse fixiert wird. Die vorgestellte Methode der in vitro Erzeugung von Zygoten aus einzelnen Gameten ermöglicht auch bei höheren Pflanzen definierte Untersuchungen über die Rolle der Zellpolarität, der Zellwandbildung und des Zytoskeletts sowie elektrophysiologische Experimente bei der frühen Zygotenentwicklung. Viele Fragen sind zu beantworten und insbesondere im Vergleich zu tierischen Systemen und denen niederer Pflanzen interessant: Worin besteht zum Beispiel der Beitrag der Spermazelle an der Eizellaktivierung? Welche Rolle spielt Kalzium bei befruchtungsinduzierten Signalübertragugen (TIRLAPUR et al., 1995)? Kommt es nach der Befruchtung zur Ca2+ Freisetzung, zu einer Membrandepolarisierung, zu Transportveränderungen, PIP2-Hydrolyse, einem Anstieg des Sauerstoffverbrauchs und H2O2-Produktion (Tab. 1)? Die Entwicklung der Zygoten und Proembryonen geschieht in vitro ohne Endosperm. Da es jetzt möglich ist, eine Zentralzelle mit einer Spermazelle zu fusionieren, und in vitro Endosperm erzeugt werden kann, ergeben sich eine Reihe weiterer experimenteller Ansätze, zum Beispiel Studien der Zellkommunikation mit diesen individuell kultivierten hoch spezialisierten Zellen und Gewebetypen.
Die Methode der in vitro Befruchtung mit einzelnen isolierten Gameten dürfte auch bei anderen ökonomisch bedeutsamen Pflanzenarten Anwendung finden. Da es jetzt möglich ist, befruchtete Eizellen individuell zu kultivieren als auch effizient aus diesen fertile Pflanzen zu regenerieren, ergeben sich neue Möglichkeiten zur genetischen Manipulation. Transformation ist von großem Interesse, und sowohl Gameten als auch künstlich erzeugte Zygoten dürften attraktive Zielzellen sein. Es sollte möglich sein, sowohl beide Arten von Gameten als auch Zygoten vor der ersten Zellteilung zu manipulieren, insbesondere in Kombination mit Transformationsmethoden, wie Elektroporation und Mikroinjektion.
Die Injektion von isolierten Spermazellen und -kernen in Zellen des Embryosacks ist beschrieben worden (KEIJZER, 1992; MATTHYS-ROCHON et al. 1994). Diese Techniken könnten ebenfalls für Studien der doppelten Befruchtung und frühen Embryogenese interessant sein. Allerdings sind derartige Manipulationen schwierig durchzuführen, und bisher sind keine Zellteilungen beschrieben worden.
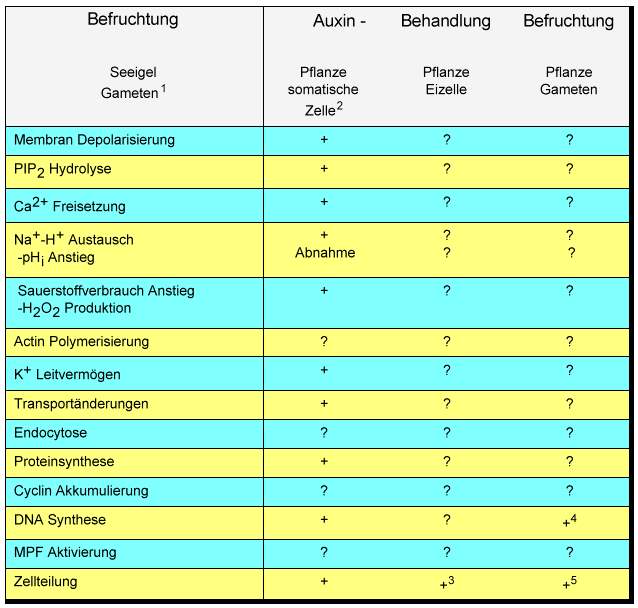
1 Ref. in EPEL, 1990; 2 Ref. in DUDITS, 1995; 3 KRANZ et al., 1995; 4 MOGENSEN und HOLM, 1995, 5 KRANZ et al., 1990.
Weiterführende Versuche sollten klären, inwieweit die Methode der in vitro Befruchtung mit einzelnen Gameten auch bei taxonomisch entfernten Arten angewendet werden kann. Inkompatibilitätsbarrieren, die Pollenkeimung und -schlauchwachstum hemmen, sollten mit dieser Methode zu überwinden sein. Zygotische Inkompatibilität ist allerdings in Kombinationen mit entfernt verwandten Arten zu erwarten, wie sie nach Bestäubung von Samenanlagen beobachtet wurde (ZENKTELER, 1995). Inkompatibilitäten der Zygote und des Embryos mit dem umliegenden mütterlichen Gewebe könnten möglicherweise durch in vitro Kulturbedingungen, insbesondere durch Anwendung spezieller Kulturmedien, umgangen werden. Jedoch ist zu bedenken, daß somatische Zellhybridisierung mit taxonomisch weit entfernten Arten häufig mit einem Verlust der Pflanzenregeneration oder Sterilität, verursacht durch Aneuploidie, Polyploidisierung und die Eliminierung von Teilen oder gar ganzer Chromosomen, einhergeht. Es ist daher zu vermuten, daß Hybridpflanzen, insbesondere mit eng verwandten Arten zu erwarten sind (KRANZ und LÖRZ, 1991; KRANZ und DRESSELHAUS, 1996). Erste Versuche haben ergeben, daß Zellteilungen der isolierten Eizelle von Mais durch Fusion mit Spermazellen von Weizen, Gerste, Hirse und Coix induziert werden und sich multizelluläre Strukturen aus diesen Fusionsprodukten entwickeln (KRANZ et al., 1995; Abb. 22). Fusionsprodukte aus einer Mais-Eizelle und und einer Raps-Spermazelle teilten sich jedoch niemals. Diese Fusionskombination resultierte in einem schnellen Zelltod. Generell sei zur Regeneration von Pflanzen aus einer einzelnen, individuell kultivierten Zelle angemerkt, daß dies nach wie vor schwierig ist. Es ist daher von großem Interesse, ein Verfahren ohne Zuhilfenahme von Ammengewebe zu entwickeln, bei dem effizientes und dauerhaftes Wachstum zu größeren Strukturen möglich ist.
Es ist anzunehmen, daß zukünftig die molekulare Bearbeitung dieses Experimentalsystems einen breiten Rahmen einnehmen wird. Über die Entwicklung der befruchteten Eizelle höherer Pflanzen ist auf molekularer Ebene nur sehr wenig bekannt. Dies unterscheidet sich von der Situation bei tierischen Systemen, wo bereits beträchtliche Informationen über die Zygotenentwicklung und frühe morphogenetische Prozesse vorliegen. Die genetische Kontrolle der Embryonalentwicklung wird insbesondere an der Taufliege (Drosophila), dem Krallenfrosch (Xenopus) und der Maus untersucht. Zahlreiche entwicklungsspezifische Gene in tierischen Systemen sind bereits näher charakterisiert worden. Es gibt bisher wenig Beispiele der Isolierung solcher Gene bei Pflanzen. Dies ist damit zu erklären, daß Oozyten und tierische Eizellen viel leichter zu isolieren und zu handhaben sind. Jedoch werden die analytischen Methoden ständig leistungsfähiger, sodaß zukünftig auch von sehr wenig Ausgangsmaterial immer mehr Information gewonnen werden kann. Dabei haben beispielsweise PCR-Methoden große Bedeutung erlangt, und Genexpressions-Studien sind mit bekannten Genen, selbst auf dem Niveau einer einzelnen pflanzlichen Zelle, möglich geworden (KARRER et al., 1995; RICHERT et al., 1996). Aus pflanzlichen Eizellen und in vitro Zygoten (18 Stunden nach in vitro Befruchtung) konnten mRNA's angereichert und mit Hilfe der PCR-Methode cDNA-Genbanken konstruiert werden (DRESSELHAUS et al., 1994; KRANZ und DRESSELHAUS, 1996). Gegenwärtig werden die durch differentielles Screening isolierten cDNA-Klone charakterisiert. Die Funktionsanalyse der gefundenen Klone ist eine weitere Aufgabe. Um Genexpression zu untersuchen, bieten sich in situ Experimente mit entwicklungsspezifischen Klonen an isolierten Eizellen, sich entwickelnden Zygoten und Embryonen an. Erkenntnisse über die Funktion der isolierten Gene können u.a. durch den Einsatz von antisense-RNA gewonnen werden. Mikroinjizierte antisense-RNA der entsprechenden Klone in die Eizelle oder in die Zygote könnte dabei die Entwicklung dieser Zellen verändern.
Die Möglichkeit der Fusion zweier Gameten unterschiedlichen Geschlechts und der Entwicklung der Zygote in vitro zu differenzierten Strukturen und nicht einfach zu unorganisiertem Kallus eröffnet neue Perspektiven des Studiums der experimentellen Embryologie bei höheren Pflanzen.
ABBE, E.C. und STEIN, O.L. (1954). The growth of the shoot apex in maize: Embryogeny. Am. J. Bot. 41, 285-293.
CAMPENOT, M.K., ZHANG, G.C., CUTLER, A.J. und CASS, D.D. (1992). Zea mays embryo sacs in culture. I. Plant regeneration from 1 day after pollination embryos. Am. J. Bot. 79, 1368-1373.
DRESSELHAUS, T., LÖRZ, H. und KRANZ, E. (1994). Representative cDNA libraries from few plant cells. Plant J. 5, 605-610.
DUDITS, D., GYÖRGYEY, J., BÖGRE, L. und BAKÓ, L. (1995). Molecular biology of somatic embryogenesis. In In vitro Embryogenesis in Plants (T.A. THORPE, ed.), Kluwer. pp. 267-308.
DUMAS, C. und FAURE, J.-E. (1995). Use of in vitro fertilization and zygote culture in crop improvement. Curr. Opin. Biotechnol. 6, 183-188.
DUMAS, C. und RUSSELL, S.D., eds. (1992). Sexual reproduction in flowering plants. Int. Rev. Cyt. 140, Academic Press.
FAURE, J.-E., MOGENSEN, H.L., KRANZ, E., DIGONNET, C. und DUMAS, C. (1992). Ultrastructural characterization and three-dimensional reconstruction of isolated maize (Zea mays L.) egg cell protoplasts. Protoplasma 171, 97-103.
FAURE, J.-E., MOGENSEN, H.L., DUMAS, C., LÖRZ, H. und KRANZ, E. (1993). Karyogamy after electrofusion of single egg and sperm cell protoplasts from maize: Cytological evidence and time course. Plant Cell 5, 747-755.
FAURE, J.-E., DIGONNET, C. und DUMAS, C. (1994a). An in vitro system for adhesion and fusion of maize gametes. Science 263, 1598-1600.
FAURE, J.-E., DIGONNET, C., MOL, R., MATTHYS-ROCHON, E. und DUMAS, C. (1994b). In vitro pollination and fertilisation in maize (Zea mays L.): Technical procedures and prospects for the dissection of the double fertilization process. Plant Sci. 104, 1-10.
GOLDBERG, R.B., de PAVIA, G. und YADEGARI, R. (1994). Plant embryogenesis: Zygote to seed. Science 266, 605-614.
HOLM, P. B., KNUDSEN, S., MOURITZEN, P. NEGRI, D., OLSEN, F.L. und ROUÉ, C. (1994). Regeneration of fertile barley plants from mechanically isolated protoplasts of the fertilized egg cell. Plant Cell 6, 531-543.
KANTA, K., RANGA SWAMY, N.S. und MAHESHWARI, P. (1962). Test-tube fertilization in a flowering plant. Nature 194, 1214-1217.
KARRER, E.E., LINCOLN, J.E., HOGENHOUT, S., BENNETT, A.B., BOSTOCK, R.M., MARTINEAU, B., LUCAS, W.J., GILCHRIST, D.G. und ALEXANDER, D. (1995). In situ isolation of mRNA from individual plant cells: Creation of cell-specific cDNA libraries. Proc. Natl. Acad. Sci. USA 92, 3814-3818.
KEIJZER, C.J. (1992). The isolation of sperm cells, their microinjection into the egg apparatus and methods for structural analysis of the injected cells. In: Sexual Plant Reproduction (M. CRESTI und TIEZZI, A., eds.), Springer, pp. 161-172.
KELLER, W.A. und MELCHERS, G. (1973). The effect of high pH and calcium on tobacco leaf protoplast fusion. Z. Naturforsch. 28 c, 737-741.
KOOP, H.-U. und SCHWEIGER H.-G. (1985a). Regeneration of plants from individually cultivated protoplasts using an improved microculture system. J. Plant Physiol. 121, 245-257.
KOOP, H.-U. und SCHWEIGER H.-G. (1985b). Regeneration of plants after electrofusion of selected pairs of protoplasts. Eur. J. Cell Biol. 39, 46-49.
KOVÁCS, M., BARNABÁS, B. und KRANZ, E. (1994). The isolation of viable egg cells of wheat (Triticum aestivum L.). Sex. Plant Reprod. 7, 311-312.
KOVÁCS, M., BARNABÁS, B. und KRANZ, E. (1995). Electro-fused isolated wheat (Triticum aestivum L.) gametes develop into multicellular structures. Plant Cell Rep. 15, 178-180.
KRANZ, E. (1992). In vitro fertilization of maize mediated by electrofusion of single gametes. In: Plant Tissue Culture Manual, Supplement 2. (K. LINDSEY, ed.), Kluwer, E1., pp. 1-12.
KRANZ, E. (1993). In vitro Befruchtung mit einzelnen isolierten Gameten von Mais (Zea mays L.) Habilitationsschrift. Universität Hamburg.
KRANZ, E. und LÖRZ, H. (1990). Micromanipulation and in vitro fertilization with single pollen grains of maize. Plant Sex. Reprod. 3, 160-169.
KRANZ, E. und LÖRZ, H. (1991). In vitro fertilization with single isolated gametes - A new tool in overcoming incompatibility barriers. Proc. Int. Conf. on "How to overcome breeding barriers by means of plant biotechnology", Miyazaki, Japan, 41-47.
KRANZ, E. und BROWN, P.T.H. (1992). Micromanipulation and in vitro fertilization with single pollen grains and isolated gametes of maize. In: Sexual plant reproduction. (M. CRESTI und TIEZZI, A., eds.), Springer, pp. 173-183.
KRANZ, E. und LÖRZ, H. (1993). In vitro fertilization with isolated, single gametes results in zygotic embryogenesis and fertile maize plants. Plant Cell 5, 739-746.
KRANZ, E. und LÖRZ, H. (1994). In vitro fertilisation of maize by single egg and sperm cell protoplast fusion mediated by high calcium and high pH. Zygote 2, 125-128.
KRANZ, E. und DRESSELHAUS, T. (1996). In vitro fertilization with isolated higher plant gametes. Trends in Plant Science 1, 82-89.
KRANZ, E., BAUTOR, J. und LÖRZ, H. (1990). In vitro fertilization of single, isolated gametes, transmission of cytoplasmic organelles and cell reconstitution of maize (Zea mays L.). In: Progress in Plant Cellular and Molecular Biology. (H.J.J. NIJKAMP, VAN DER PLAS, L.H.W. und VAN AARTRIJK, J., eds.), Proceedings of the VIIth International Congress on Plant Tissue and Cell Culture, Amsterdam, The Netherlands, 24-29 June 1990. Kluwer, pp. 252-257.
KRANZ, E., BAUTOR, J. und LÖRZ, H. (1991a). In vitro fertilization of single, isolated gametes of maize mediated by electrofusion. Sex. Plant Reprod. 4, 12-16.
KRANZ, E., BAUTOR, J. und LÖRZ, H. (1991b). Electrofusion-mediated transmission of cytoplasmic organelles through the in vitro fertilization process, fusion of sperm cells with synergids and central cells, and cell reconstitution in maize. Sex. Plant Reprod. 4, 17-21.
KRANZ, E., LÖRZ, H., DIGONNET, C. und FAURE, J.-E. (1992). In vitro fusion of gametes and production of zygotes. Int. Rev. Cytol. 140, 407-423.
KRANZ, E., VON WIEGEN, P., und LÖRZ, H. (1995). Early cytological events after induction of cell division in egg cells and zygote development following in vitro fertilization with angiosperm gametes. Plant J. 8, 9-23.
MATTHYS-ROCHON, E., MÓL, R., HEIZMAN, P. und DUMAS, C. (1994). Isolation and microinjection of active sperm nuclei into egg cells and central cells of isolated maize embryo sacs. Zygote 2, 29-35.
MOGENSEN, H.L. und HOLM, P.B. (1995). Dynamics of nuclear DNA quantities during zygote development in barley. Plant Cell 7, 487-494.
MÓL, R., MATTHYS-ROCHON, E., und DUMAS, C. (1993). In-vitro culture of fertilised embryo sacs of maize: zygotes and two-celled proembryos can develop into plants. Planta 189, 213-217.
MURASHIGE, T. und SKOOG, F. (1962). A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiol. Plant. 15, 473-497.
REISER, L. und FISCHER, R.L. (1993). The ovule and the embryo sac. Plant Cell 5, 1291-1301.
RICHERT, J., KRANZ, E., LÖRZ, H. und DRESSELHAUS, T. (1996). A reverse transcriptase-polymerase chain reaction assay for gene expression studies at the single cell level. Plant Sci. 114, 93-99.
SCHWEIGER, H.-G., DIRK, J., KOOP, H.-U., KRANZ, E., NEUHAUS, G., SPANGENBERG, G. und WOLFF, D. (1987). Individual selection, culture and manipulation of higher plant cells. Theor. Appl. Genet. 73, 769-783.
SPANGENBERG, G. und KOOP, H.-U. (1992). Low density cultures: microdroplets and single cell nurse cultures. In Plant Tissue Culture Manual, Supplement 2. (K. LINDSEY, ed.), Kluwer, A10, pp.1-28.
THEUNIS, C.H., PIERSON, E.S. und CRESTI, M. (1991). Isolation of male and female gametes in higher plants. Sex. Plant Reprod. 4, 145-154.
TIRLAPUR, U., KRANZ, E. und CRESTI, M. (1995). Characterisation of isolated egg cells, in vitro fusion products and zygotes of Zea mays L. using the technique of image analysis and confocal laser scanning microscopy. Zygote 3, 57-64.
VAN DER MAAS, H. M., ZAAL, M.A.C.M., DE JONG, E.R., KRENS, F.A. und VAN WENT, J.L. (1993). Isolation of viable egg cells of perennial ryegrass (Lolium perenne L.). Protoplasma 173, 86-89.
WEST, M.A.L. und HARADA, J.J. (1993). Embryogenesis in higher plants: an overview: Plant Cell 5, 1361-1369.
ZENKTELER, M. (1995). Self and cross pollination of ovules in test tubes. In: Current Issues in Plant Molecular and Cellular Biology (M. TERZI, CELLA, R. und FALAVIGNA, A., eds.), Kluwer, pp. 191-199.