Das Mikrofilamentsystem (Aktin-Myosin-System) wurde zunächst als das für Muskelkontraktionen ausschlaggebende Prinzip erkannt. H. E. HUXLEY (Medical Research Council, Laboratory of Molecular Biology, Cambridge/Engl.) konnte den molekularen Aufbau einer Muskelzelle zu Beginn der sechziger Jahre durch Auswertung elektronenmikroskopischer Aufnahmen aufklären und den Kontraktionsmechanismus als ein teleskopartiges Aneinandervorbeischieben von parallel zueinander angeordneten Filamenten deuten. Dem Myosin fällt dabei die Aufgabe einer ATPase zu, die erst dann zur Wirkung kommt, wenn Aktin und Myosin Kontakt miteinander aufgenommen haben.
Später konnte gezeigt werden, daß Aktin eines der häufigsten Proteine in allen tierischen Zellen ist. Der Nachweis kann auf drei verschiedenen Wegen erfolgen:
Bindung von Myosin: Ein Myosinmolekül besteht aus zwei Teilen, einem Kopf, in dem die Polypeptidkette zu einer spezifischen Tertiärstruktur gefaltet ist, und einem Schwanz, in dem es als lange ununterbrochene alpha-Helix vorliegt. Die Köpfe können durch eine Trypsinbehandlung abgetrennt und in reiner Form gewonnen werden. Sie verlieren dadurch nicht die Fähigkeit, sich an Aktinfilamente anzulagern. In elektronenmikroskopischen Bildern (negative staining) erkennt man den Aktin/Myosinkopf-Komplex durch sein charakteristisches, pfeilspitzenförmiges Aussehen. Da die Pfeile entlang eines Aktinpolymers stets in eine Richtung weisen, ist anzunehmen, daß in ihm eine Polarität enthalten ist. Der Nachteil der Methode: Man benötigt mehr oder weniger vorgereinigte Aktinfilamente, zumindest jedoch Zelltrümmer.
Indirekte Immunfluoreszenz: Dieses Verfahren wurde 1974 von E. LAZARIDES und K. WEBER (seinerzeit Harvard University, Cambridge/Mass.) erarbeitet, es erwies sich als eine der erfolgreichsten Methoden der modernen Zellbiologie. Aktin ist ein relativ konservatives Protein, d.h., daß eine Antikörperpopulation, die gegen tierisches Aktin gerichtet ist, mit dem Aktin fast aller Tiergruppen und mit dem der Schleimpilze reagiert. Gegenüber dem unter (1.) vorgestellten Verfahren hat dieses den Vorteil, das vollständige Mikrofilamentsystem einer Zelle abzubilden, sowie Veränderungen im Verlauf des Zellzyklus oder der Entwicklung des Organismus zu erfassen. Voraussetzung ist natürlich, daß es gelingt, die Antikörper in die Zellen einzuführen. Das Standardverfahren sieht vor, die Zellen mit Glutaraldehyd zu fixieren und die Membran anschließend aufzulösen oder zumindest soweit durchlässig zu machen, daß Moleküle der Größe von Antikörpern eindringen können. Eine weitere Möglichkeit wäre die Mikroinjektion der markierten Antikörper in lebende Zellen. Die Zellwand setzt der Anwendung bei Pflanzen Grenzen. Protoplasten bieten einen möglichen Ausweg aus diesem Dilemma.
Markierung von Mikrofilamenten durch fluoreszenzmarkiertes Phalloidin (Phallotoxin), dem Gift des Weißen Knollenblätterpilzes (Amanita phalloides). Es hat eine hohe Affinität zum F-Aktin aus Leber- und Muskelzellen, mit dem es feste Komplexe eingeht. Desgleichen bindet es an pflanzliches Aktin, so daß nunmehr eine Sonde zur Verfügung steht, die den Engpaß an verfügbaren Antikörpern gegen pflanzliches Aktin mildert, ohne daß Spezifitätseinbußen in Kauf genommen werden müssen.
Wie schon erwähnt, ist F-Aktin in tierischen Zellen mit einer Anzahl von Proteinen assoziiert: Myosin, Troponin (A, B, C), Tropomyosin, alpha-Aktinin u.a. Es gibt bisher nur wenige Angaben über deren Vorkommen in Pflanzenzellen. Myosin, oder eine myosinähnliche Verbindung, scheint, zumindest dort wo man gesucht hat, vorhanden zu sein (Nitella, Lycopersicon).
Es gibt eine Anzahl von Inhibitoren der Mikrofilamente. Einer der bekanntesten ist das Cytochalasin B (ein Pilzgift), das die Polymerisation des Aktins unterbindet und das deshalb in der Zellbiologie oft zur Unterscheidung von Mikrofilament- und Mikrotubulisystem herangezogen wird.
Es gilt als sicher, daß Mikrofilamente an der Protoplasmaströmung in den Internodialzellen der Armleuchteralgen Chara und Nitella, an der Chloroplastendrehung von Mougeotia, der Chloroplastenbewegung von Vallisneria, vielleicht auch beim Auswachsen von Pollenschläuchen und der Kernwanderung von Acetabularia beteiligt sind. Doch gerade am letzten Beispiel zeigte sich, daß auch Mikrotubuli an dieser Bewegung mitwirken und daß beide Systeme eng miteinander kooperieren (H. U. KOOP und O. KIERMEYER, Universität Salzburg, 1980).
Mitte der achziger Jahre haben M. V. PARTHASARATHY und Mitarbeiter (Cornell University, Ithaca, N.Y., 1985) Mikrofilamente durch Phalloidin-Markierung bei einer ganzen Reihe verschiedener Pflanzentypen identifiziert und damit gezeigt, daß sie auch in Pflanzen weit verbreitet sind und in den Zellen selbst klar strukturierte Cytoskelette ausbilden. Sie bilden in der Tat das Grundgerüst der Plasmastränge, wirken an der plasmatischen Bewegung mit, stehen mit den Plastiden in direktem Kontakt und sind in Pollenschläuchen reichlich vorhanden. Der Zellkern wird von einem geschlossenen Netzwerk aus Mikrofilamenten umgeben (nuclear basket).
In Schleimpilzen und deren Plasmodien wirkt Aktin an der amöboiden Bewegung mit und ist für die intensive pulsierende Bewegung des Plasmas verantwortlich. Amöboide Bewegung ist im Pflanzenreich selten, eventuell kann man das Auswachsen von Pollenschläuchen mit einer solchen vergleichen; bemerkenswert wäre es, denn das würde bedeuten, daß Aktin am Befruchtungsvorgang höherer Pflanzen beteiligt ist (bei niederen Pflanzen wirken begeißelte Spermien mit, und an deren Bewegung Mikrotubuli).
Chara und Nitella: Die riesigen, mehrere Zentimeter langen, ca. einen Millimeter dicken Internodialzellen sind seit ihrer Entdeckung beliebte Versuchsobjekte der Bewegungsphysiologen, denn in ihnen ist das Plasma (mit Ausnahme der Plastiden) in ständiger, rotierender Bewegung. Die Plastiden wiederum sind stationär in einem regelmäßigen Muster wandständig (cortical) ausgerichtet.
In den dreißiger Jahren wies K. ARENS (Universität von Rio de Janeiro) eine "physiologische Multipolarität" der Zellen nach. Er sah, daß in bestimmten regelmäßigen Abständen entlang der Zellwand Calcium-Ionen abgeschieden werden, die sich an der Außenseite als Kalkinkrustierungen ablagern können. Nach allem, was man durch das Studium tierischer Zellen, speziell der Muskelzellen weiß, sind Calcium-Ionen essentielle Regulatoren der Aktin-Myosin-Interaktion und damit auch der Zell- respektive Muskelbewegung. Es bleibt zu fragen, ob sie in Nitella oder Chara in gleicher Weise wirken.
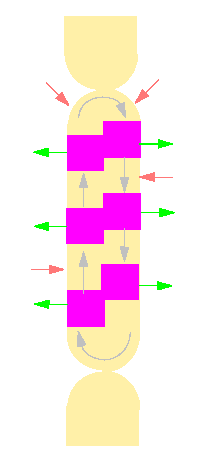
Schematische Darstellung einer physiologischen Multipolarität in einer Internodialzelle von Nitella. Die Pfeile in der Zelle geben die Richtung der Plasmabewegung an. Die in magenta gekennzeichneten Flächen sind Zonen, in denen an der Zelloberfläche Calciumionen abgesondert werden, in den hellen Bereichen erfolgt eine Calciumionenaufnahme (Nach K. ARENS und R. JAROSCH, 1939)
R. JAROSCH (Mikrobiologische Station der Stadt Linz in Österreich) wies 1958 im Preßsaft aus Chara-Zellen Proteinfibrillen nach (sichtbar im Dunkelfeldmikroskop) und erkannte, daß sie sich ihrerseits zu Ringen schließen, die rotierende Bewegungen ausüben. Vielfach sind sie mit anderen Plasmapartikeln besetzt. JAROSCH hielt sie daher für die, wie er sagte, Impulsträger der Plasmabewegung, denn er konnte auch zeigen, daß sich die Bewegung impulsartig wie eine Welle entlang des Rings ausbreitete. Jahre später (1972) sah E. KAMITSUBO (Osaka University), daß sich - nach Zentrifugation - auch innerhalb von Zellen Ringe bilden. Auch diese zeichnen sich durch eine autonome rotierende Bewegung aus. Die Beobachtungen weisen darauf hin, daß saltatorische Bewegungen von Zellorganellen (Mitochondrien, Microbodies usw.) ebenfalls darauf beruhen können, daß die Organellen an rotierende fibrilläre Systeme gebunden sind.
Die Verbesserung mikroskopischer Techniken erlaubte es, die Lage von Proteinfibrillen in Chara- und Nitella-Zellen zu bestimmen. Besonders eindrucksvoll sind die Ergebnisse der phasenkontrast-, interferenzkontrast- und rasterelektronenmikroskopischen Untersuchungen.
Aus den Abbildungen ist ersichtlich, daß sie in Reihen von drei bis vier parallel liegenden Filamenten an der Grenzschicht von stationärem Ektoplasma (mit Plastiden) und dem beweglichen Endoplasma liegen. Mitte der siebziger Jahre wurde schließlich gezeigt, daß sie tatsächlich aktinhaltig sind (R. E. WILLIAMSON, 1974, B. A. PALEVITZ, J. F. ASH, P. K. HEPLER, 1974, B. A. PALEVITZ und P. K. HEPLER, 1975) und daß alle parallelliegenden Mikrofilamente gleich orientiert sind. Ein Nachweis durch Markierung mit monoklonalen Antikörpern ergänzt die Aussagen. Die Strömungsgeschwindigkeit des Endoplasmas ist ATP-abhängig. Auch das entspricht dem, was wir von Muskelzellen her wissen.
Die neueste Methode in der Lichtmikroskopie ist die Konfokale Laser Scan Mikroskopie, bei der Objekte Schicht für Schicht erfaßt und mit einem Computerprogramm ausgewertet werden. Besonders eindrucksvoll ist die Darstellung fluorezenzmarkierter beweglicher Objekte, so z. B. der Elemente des Endoplasmatischen Retikulums, anderer Membransysteme (z. B. Golgi-Apparate) und des Cytoskeletts. Hierbei wird deutlich, daß Mikrofilamentbündel eng mit dem ER verknüpft sind, und daß z. B. Golgi-Apparate sich - wie auf Schienen - entlang der Filamente bewegen. Einen Beitrag hierzu (mit Filmsequenzen) von Cris HAWES (Oxford Brookes University) findet man unter:
| Diese Datei ist in Botanik online gespiegelt (Stand vom 19. 6.99). Sie erreichen sie durch Anklicken von
Das Herunterladen der Videoclips aus dem Netz (durch Anklicken des jeweiligen Links in der Datei) dauert extrem lange. Es empfiehlt sich daher, die heruntergeladenen Sequenzen auf die eigene Festplatte zu kopieren. Der Bewegungsablauf wird durch Klicken in das Bild gestartet. Die Videoclips können unter Windows 95 auch direkt aus dem Windows Explorer heraus geöffnet werden (AVI-Dateien). |
Golgi-Vesikel, Endoplasmatisches Retikulum und Aktinnetzwerk in Epidermiszellen. Die Golgi-Vesikel und das ER wurden mit GFP ("green fluorescent protein") markiert, die Aktinfilamente mit Rhodamin-Phaloidin. Sie erscheinen daher im Bild als rote Stränge. Das corticale Netzwerk der Aktinfilamente wird vom ER-Netzwerk überlagert. Die deutlich grün markierten Golgi-Vesikel sind ebenfalls mit dem Aktin-Netzwerk assoziiert.© C. HAWES, A. BETTERIDGE, P. BOEVINK, S. SANTA CRUZ & K. OPARKA
|
|