Durch die Elektronenmikroskopie konnte das vollständige Repertoire subzellulärer Organellen und anderer Einschlüsse sichtbar gemacht werden. Doch wie bereits ausgeführt, lassen sich im Elektronenmikroskop keine lebenden Einheiten beobachten; so ist es allenfalls durch Vergleich von Bildserien möglich, einen gewissen Eindruck von den dynamischen Prozessen im Zellplasma zu gewinnen. In den letzten Jahren sind verschiedene lichtmikroskopische Techniken optimiert worden, neue außerordentlich spezifische Fluoreszenzfarbstoffe wurden gefunden und die Nutzung von Videocameras und Computern verbesserte die Bilddokumentation und -auswertung. Drei der Verfahren sollen mit Beispielen im folgenden besprochen werden: die UV-Mikroskopie, AVEC-DIC und der Einsatz neuer Fluorochrome.
Die UV-Mikroskopie ist keine neue Technik. Zwei ihrer Vorteile wären zu nennen:
UV-Licht (ultraviolettes Licht der Wellenlängen unter lambda = 310 mn) ist kurzwelliger als sichtbares Licht (lambda = 800-400 nm). Die ABBÉsche Auflösungsgrenze wird somit von ca. 0,2 µm auf ca. 0,1 µm gesenkt.
Viele subzelluläre Strukturen absorbieren aufgrund ihres Gehalts an Proteinen und Nukleinsäuren ultraviolettes Licht und können daher ohne zusätzliche Kontrastierung erkannt werden.
Dennoch hatte sich die UV-Mikroskopie lange Zeit nicht durchsetzen können. Das lag vor allem an Schwierigkeiten in der Dokumentation der Ergebnisse. Erst nach Einsatz leistungsfähiger Videocameras kamen die Vorteile voll zur Geltung (I. K. LICHTSCHEIDL und W. G. URL, Institut für Pflanzenphysiologie, Universität Wien, 1987). Außer dem Zellkern können Mitochondrien, Plastiden, Sphärosomen, der Golgi-Apparat u.a. sicher identifiziert werden. Daneben sind tubuläre Elemente (Ø 100 nm oder mehr) nachweisbar, die sich durch Vergleich mit Ergebnissen elektronenmikroskopischer und fluoreszenzmikroskopischer Untersuchungen als Teile des Endoplasmatischen Retikulums (ER) erwiesen. In zellwandnahem ruhendem Plasma sind sie oft in Form eines polygonalen Netzwerks angeordnet, in strömendem Plasma sind sie in Strömungsrichtung ausgerichtet . Ferner sieht man Aktinfilamentbündel, die sich einer elektronenmikroskopischen Analyse mangels geeigneter Kontrastierung normalerweise entziehen. In einzelnen UV-mikroskopischen Bildern sind sie nur schwer vom tubulären ER unterscheidbar. Ihre Mitwirkung an Bewegungsabläufen kennzeichnet sie jedoch als vom ER verschiedene Strukturen. Zudem können sie durch Wahl spezifischer Fluorochrome im Fluoreszenzmikroskop eindeutig identifiziert werden (s. a. folgende Abschnitte).
R. D. ALLEN hat das nach ihm benannte Allen's video-enhanced contrast, differential interference contrast-Verfahren entwickelt. Es beruht im wesentlichen auf einer Bildauswertung interferenzkontrastmikroskopischer Aufnahmen. Die von einer Videocamera festgehaltenen Bilder können digitalisiert werden und sind somit einer computergesteuerten Analyse zugänglich. Durch Subtraktion können z.B. alle identischen Strukturen in zeitlich aufeinanderfolgenden Bildern gelöscht werden. Als Ergebnis erhält man die Abbildung aller beweglichen Teilchen. Es lassen.sich aber auch Bilder unterschiedlicher Tiefenschärfeebenen voneinander subtrahieren, wodurch störender Bildhintergrund herausgefiltert wird. Das Verfahren hat sich in den letzten Jahren zunehmend als Methode der Wahl zum Studium von Bewegungsabläufen und des Cytoskeletts der Zelle bewährt.
N. S. ALLEN und R. D. ALLEN (1978) und I. K. LICHTSCHEIDL und D. G. WEISS (1987) haben das Verfahren zur Analyse der Plasmabewegung in pflanzlichen Zellen (Chara, Allium cepa u.a.) eingesetzt. Seine Stärke kommt in den hier wiedergegebenen Abbildungen nur unvollständig zur Geltung. Erst in Videofilmen erkennt man das ganze Ausmaß der Bewegungsabläufe im Plasma. Durch die Auswertung der Filme lassen sich die unterschiedlichen Bewegungsgeschwindigkeiten der einzelnen Partikel ermitteln. Es kann gezeigt werden, daß bestimmte Partikel entlang von Aktinfilamentbündeln wandern und ihre Richtung ändern, sobald sie von einem Aktinfilamentbündel auf eines mit anderer Polarität springen. Es zeigt sich auch, daß das ER als ein mechanisches Hindernis wirkt, das der Wanderung mancher Partikel im Wege steht.
Das lipophile Kation 3,3-Dihexyloxacarbocyanin-Jodid (DiOC) erwies sich als idealer Marker des ER und anderer Membransysteme (H. QUADER und E. SCHNEPF, Zellenlehre, Universität Heidelberg, 1986).
Da die Zellen hierbei nicht fixiert werden und das Fluorochrom - zumindest zeitweise - die zellulären Funktionen nicht merklich beeinträchtigt, eignet es sich zum Studium des Membranflusses in lebenden Zellen. Anders sieht es mit fluoreszenzmarkiertem Phalloidin, dem Gift des Knollenblätterpilzes aus, das sich als aktinspezifisch herausgestellt hat und daher zum Nachweis von Aktinfilamenten in fixierten Zellen herangezogen werden kann. Aktinfilamente sind in Kernnähe besonders häufig, von dort aus erstrecken sie sich über das ganze Zellplasma. Sie sind in anfangs dicken Bündeln oder Kabeln vereint, die sich in zunehmendem Abstand vom Kern immer weiter aufspalten.
Die neueste Methode in der Lichtmikroskopie ist die Konfokale Laser Scan Mikroskopie, bei der Objekte Schicht für Schicht erfaßt und mit einem Computerprogramm ausgewertet werden. Besonders eindrucksvoll ist die Darstellung fluorezenzmarkierter beweglicher Objekte, so z. B. der Elemente des Endoplasmatischen Retikulums, anderer Membransysteme (z. B. Golgi-Apparate) und des Cytoskeletts. Hierbei wird deutlich, daß Mikrofilamentbündel eng mit dem ER verknüpft sind, und daß z. B. Golgi-Apparate sich - wie auf Schienen - entlang der Filamente bewegen. Einen Beitrag hierzu (mit Filmsequenzen) von Cris HAWES (Oxford Brookes University) findet man unter:
| Diese Datei ist in Botanik online gespiegelt (19.6.99). Sie erreichen sie durch Anklicken von
Das Herunterladen der Videoclips aus dem Netz (durch Anklicken des jeweiligen Links in der Datei) dauert extrem lange. Es empfiehlt sich daher, die heruntergeladenen Sequenzen auf die eigene Festplatte zu kopieren. Der Bewegungsablauf wird durch Klicken in das Bild gestartet. Die Videoclips können unter Windows 95 auch direkt aus dem Windows Explorer heraus geöffnet werden (AVI-Dateien). |
Golgi-Vesikel und corticales ER-Netzwerk in epidermalen Zellen - markiert mit GFP ("green fluorescent protein": Golgi-Vesikel deutlich, ER im rechten Bild schwach grün fluorezierend) - Einzelheiten siehe die zitierte Arbeit von C. HAWES. Die Golgi-Vesikel bewegen sich bidirektioal entlang der ER-Stränge.
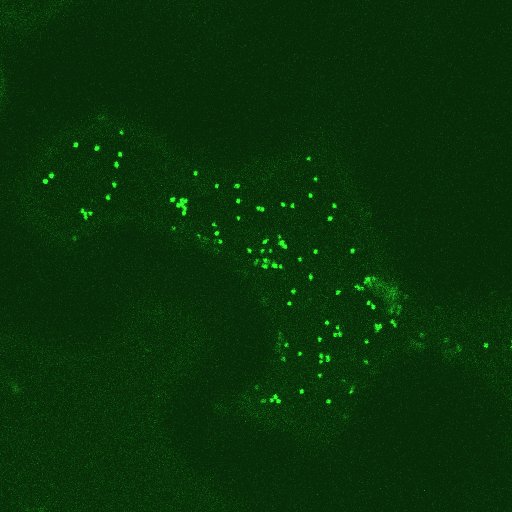
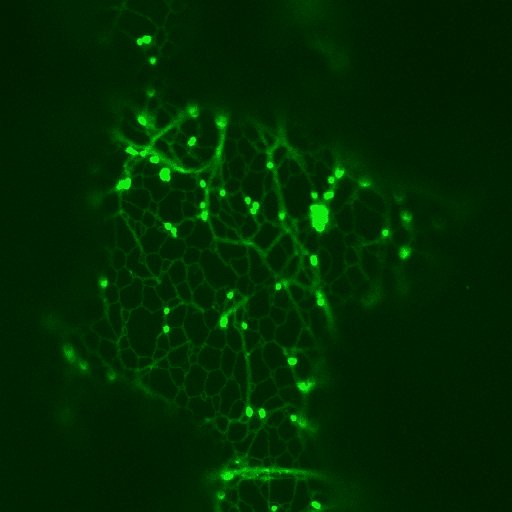
Durch Anklicken der Bilder kann eine zugehörige AVI-Datei aufgerufen werden. Der Bewegungsablauf kann durch Klicken in die AVI-Datei ausgelöst und / oder unterbrochen werden.
© C. HAWES.
siehe auch: Strukturveränderungen des Endoplasmatischen Retikulums
|
|