Nach M. EIGEN und R. WINKLER, 1975
In jeder lebenden Zelle laufen ständig Tausende verschiedener chemischer Reaktionen ab. Aufgenommene Nährstoffe werden dabei in eine Vielzahl zelleigener Komponenten umgewandelt. So entstehen verschiedene Zucker, Aminosäuren und deren Vorstufen, organische Säuren, Nukleotide, Lipide u.a. Die dazu führenden Reaktionen werden summarisch als Zellstoffwechsel bezeichnet. Bei jeder chemischen Reaktion wird entweder eine Bindung gelöst oder eine neue geknüpft. Solche Umsetzungen laufen in der Regel nur unter Energiezufuhr ab, und dadurch wird deutlich, daß Stoffwechsel und Energiehaushalt einer Zelle als voneinander abhängige Parameter zu betrachten sind. In jeder (chemischen) kovalenten Bindung eines Moleküls ist Energie festgelegt, die bei einer Spaltung freigesetzt wird und für andere Zwecke nutzbar ist. So kann sie z.B. zur Bildung einer neuen Bindung eingesetzt werden, sie kann aber auch in eine der anderen Energieformen (Bewegungs-, Wärme-, Licht- oder Elektroenergie) überführt werden. Die Mehrzahl chemischer Bindungen und so ziemlich alle, mit denen wir es in der Zelle zu tun haben, sind unter physiologischen Bedingungen stabil, sie zerfallen also nicht von alleine. Zur Molekülspaltung muß daher Energie (Aktivierungsenurgie) zugeführt werden. Im chemischen Labor bedient man sich dabei meist hoher Temperaturen, hoher Drücke oder bestimmter anorganischer oder organischer Katalysatoren.
Für Zellen kommt nur die dritte Alternative in Betracht. Biologische Katalysatoren sind ausnahmslos Proteine (Enzyme), deren Aktivität in vielen Fällen allerdings von der Anwesenheit anderer Moleküle abhängt. Die Wirkung der Enzyme ist außerordentlich selektiv, und es fallen praktisch keine unnötigen Nebenprodukte an. Man findet daher in Zellen normalerweise auch keine funktionslosen Moleküle. Durch Einsatz von Enzymen ist die Zelle in der Lage, aus zahlreichen, thermodynamisch möglichen Reaktionen gleichzeitig und nebeneinander ablaufen lassen.
Der Chemiker R. WILLSTÄTTER schrieb dazu schon 1912:
"Die unermeßliche Zahl chemischer Reaktionen in den lebenden Zellen wird durch die organischen Katalysatoren nach Richtung und Geschwindigkeit gelenkt. Leben ist das geregelte Zusammenwirken enzymatisch katalysierter Vorgänge."
Was leistet ein Enzym? Vorab eine allgemeine Antwort: Es setzt die Aktivierungsenergie einer Reaktion herab. Durch ein Enzym allein kann niemals eine Reaktion bewerkstelligt werden, bei der eine neue Bindung entsteht.
Reaktionskinetiken: A. nichtkatalysierte, B. enzymkatalysierte Umsetzung.
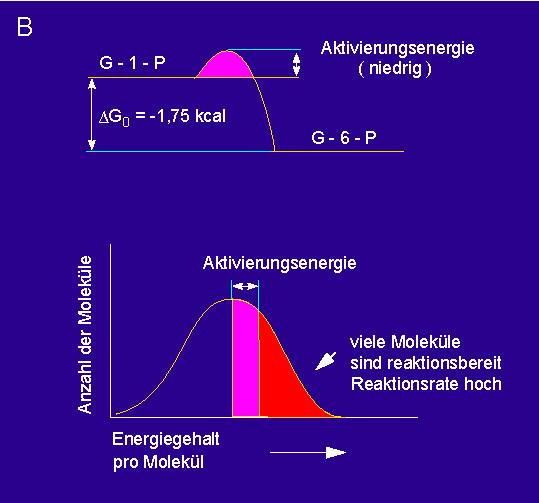
Steht jedoch zusätzlich eine Energiequelle zur Verfügung, zeigt sich, daß Enzyme auch an Reaktionen dieser Art beteiligt sind. Zellen sind sogenannte offene Systeme, d.h., sie sind darauf angewiesen, ständig Energie und Nährstoffe aus der Umgebung aufzunehmen. Im Verlauf der Evolution haben sich nur solche Formen durchgesetzt, die die zur Verfügung stehenden Rohstoffe effizient nutzen können. Für Zellen gibt es grundsätzlich zwei Wege zur Energiegewinnung:
Die Zelle nimmt Energie in Form von Licht auf und wandelt die Lichtenergie in chemische Energie um (Photosynthese). Die Fähigkeit dazu haben ausschließlich chlorophyllhaltige Pflanzen und einige Bakterien.
Die Zelle nimmt Energie aus der Umgebung in Form reduzierter, energiereicher Moleküle auf.
Die beim stufenweisen Abbau (Gärung, Atmung) anfallende freie Energie wird in Form chemischer Bindungen gespeichert und steht nachfolgend für Aufbauprozesse zur Verfügung (oder sie wird in eine andere Energieform transformiert).
Zum Verständnis des Zellstoffwechsels und des Energiehaushalts müssen wir uns eingangs mit einigen grundlegenden Regeln der Thermodynamik befassen. Wir müssen das Wesen von Oxydation und Reduktion sowie die Eigenschaften verschiedener chemischer Bindungsklassen diskutieren, und schließlich die Mechanismen der enzymatischen Katalyse im Detail behandeln.
|
|