Ethylen ist ein ungewöhnlicher, weil gasförmiger Effektor mit einer sehr einfachen Struktur. Doch Ethylen weist eine Reihe von Eigenschaften auf, die mit denen anderer Hormone durchaus vergleichbar sind. So ist Ethylen vielfach schon in nanomolaren Konzentrationen wirksam.
BLEECKER A.B. and KENDE H (2000) Ethylene: a gaseous signal molecule in plants. Annu. Rev. Cell Dev. Biol. 16: 1-18 (2000) http://cellbio.AnnualReviews.org/cgi/content/full/16/1/1
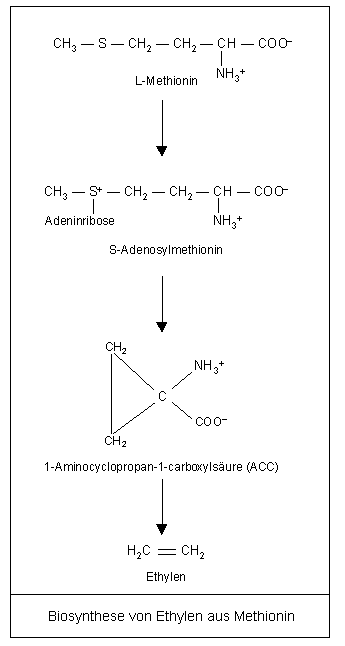
Ethylen entsteht in höheren Pflanzen aus der Aminosäure L-Methionin. Methionin wird durch die Aktivität der S-Adenosylmethionin Synthetase (EC 2.5.1.6) mit ATP zu S-Adenosylmethionin aktiviert. Zwei spezifische Schritte sind an der Ethylenbiosynthese beteiligt. Aus S-Adenosylmethionin entsteht die zyklische nicht in Proteinen vorkommende Aminosäure 1-Aminocyclopropan-1-carboxylsäure (ACC). Die Reaktion wird durch die ACC Synthase (EC 4.4.1.14) katalysiert, wobei Pyridoxalphosphat als Cofaktor dieser Umwandlung wirkt. Die Bildung von ACC ist in der Regel limitierend für die Ethylenbiosynthese. Die ACC Synthase wird in Pflanzen durch eine Multigenfamilie kodiert. Verschiedene Signale die die Ethylenbildung beeinflussen, führen zu einer verstärkten Expression einzelner Mitglieder der ACC Synthase Genfamilie. Die Umwandlung von ACC zu Ethylen erfolgt durch die ACC Oxidase. Die Reaktion ist sauerstoffabhängig. Unter vollständigem Sauerstoffausschluß kann deshalb keine Ethylensynthese erfolgen. Fe2+ ist ein Cofaktor und Ascorbat ist ein Cosubstrat dieser Reaktion. CO2 aktiviert das Enzym. ACC Oxidasen werden in Pflanzen ebenfalls durch kleine Multigenfamilien kodiert.
Die Konzentration an Ethylen hängt von der Syntheserate und von der Diffusion des Gases ab. Ethylen selbst wird nicht aktiv transportiert und es gibt keinen Abbau von Ethylen. Die Erhöhung der Ethylensynthese durch verschiedene Signale, wie Auxin oder Verwundung, findet über eine Aktivierung der ACC Synthase statt und beruht auf erhöhter Genexpression. ACC Oxidase ist in den meisten vegetativen Geweben konstitutiv vorhanden. In einigen Fällen wird allerdings auch die ACC Oxidase unter dem Einfluß von Ethylen verstärkt gebildet (positive feeback Regulation).
In verschiedenen Geweben wurde eine Stimulierung der Ethylenbildung durch Auxin nachgewiesen. In etiolierten Erbsenkeimlingen (Pisum sativum L.) sind diese beiden Hormone an der Ausbildung des apikalen Hypokotylhakens beteiligt. Man geht davon aus, daß eine Ungleichverteilung von Auxin dazu führt, daß auf der Seite der hohen Auxinkonzentration die Ethylensynthese stimuliert wird. Die resultierende hohe Ethylenkonzentration führt zur einseitigen Wachstumshemmung, wodurch eine Krümmung erfolgt.
In reifenden Früchten findet eine autokatalytische Rückkoppelung der Ethylensynthese statt. Das bedeutet, daß Ethylen seine eigene Biosynthese anregt. Die sich selbst verstärkende Synthese und die Diffusion von Ethylen sorgen für eine Synchronisation und für eine Beschleunigung des Reifungsprozesses.
Vermutlich bildet jedes Pflanzengewebe während eines seiner Entwicklungsstadien Ethylen oder nimmt es auf und reagiert entsprechend. Die Aufnahme ist zumeist unproblematisch, denn Ethylen kann ohne Schwierigkeiten durch Membranen hindurch diffundieren. Die Verteilung erfolgt in der Regel über den Gasraum der pflanzlichen Gewebe (Interzellularen) sowie - in gelöster Form - von Zelle zu Zelle. Für den Transport über eine längere Distanz wird ACC, die Vorstufe von Ethylen, über das Leitgewebe in der Pflanze zum Wirkort transportiert und dort in Ethylen umgewandelt. Zum Beispiel bildet die Tomate bei Staunässe in ihren Wurzeln ACC das zu den Blättern transportiert und dort zu Ethylen umgewandelt wird. Dort bewirkt Ethylen das epinastische Absenken der Blattstiele.
Viele Wirkungen von Ethylen sind mit einer Genaktivierung verbunden. Die Frage ist, wie Ethylen von der Zelle wahrgenommen wird und wie diese Gene aktiviert werden. Viele neuere Untersuchungen deuten darauf hin, daß Ethylen von einem Rezeptor gebunden wird, der als ein Transmembranprotein vorliegt. Die N-terminale Domäne des Rezeptorproteins ist an der Bindung von Ethylen beteiligt. Eine intrazelluläre Domäne besteht aus einer Proteinkinase, die bei Bindung von Ethylen an den N-terminalen Bereich aktiviert wird. Eine solche Rezeptorproteinkinase bezeichnet man als Zwei-Komponenten-Regulator. Zwei-Komponenten-Regulatoren bestehen allgemein aus einem Sensor und aus einem ‚Response Regulator‘. Sie kommen auch in Bakterien vor. Der erste aus Pflanzen identifizierte Zwei-Komponenten-Regulator war der Ethylenrezeptor ETR1 (ethylene resistant 1) aus der Ackerschmalwand (Arabidopsis thaliana L.). Die Signaltransduktion verläuft danach sehr wahrscheinlich über eine Kaskade von Phosphorylierungsschritten durch mehrere Proteinkinasen und möglicherweise über weitere Zwischenschritte. Am Ende der Signalkette steht ein Transkriptionsfaktor, der in der Zelle vorhanden ist und aktiviert wird. Dadurch wird die Transkription eines oder mehrerer früh induzierter Gene gefördert. Ein bekanntes frühes Gen kodiert selbst für einen Transkriptionsfaktor der zur Aktivierung von spät induzierten Genen führt. Die späten Gene können zum Beispiel für hydrolytische Enzyme, die während der Fruchtreife oder Abscission die Zellwand abbauen, oder für Proteine der Pathogenabwehr kodieren (siehe Wirkungen).
Um die Biosynthese und die Wirkung von Ethylen in Pflanzen zu untersuchen, werden häufig Hemmstoffe eingesetzt. AVG (Aminoethoxyvinylglycin) und AOA (Aminooxy-Essigsäure) sind Hemmstoffe der Ethylensynthese. NBD (2, 5-Norbornadien) und Ag+ dagegen hemmen die Wirkung von Ethylen indem sie an den Ethylenrezeptor binden. Dabei ist NBD sehr viel spezifischer als Silberionen.
Schon in der ersten Hälfte des letzten Jahrhunderts beobachtete man, daß Ethylen die Abscission von Früchten sowie die Fruchtreife fördert. Seit 1934 weiß man, daß es auch von den Pflanzen selbst produziert wird. Viele klimakterische Früchte wie Äpfel, Bananen und Tomaten zeigen im späten grünen Stadium einen steilen Anstieg der Ethylensynthese. Als Folge werden Chlorophylle ab- und andere Pigmente aufgebaut. Die typische Farbe der Fruchtwand entsteht. Die Aktivität etlicher für den Reifeprozeß benötigter Enzyme nimmt zu. Stärke und organische Säuren, in einzelnen Fällen (z.B. bei der Avocadofrucht) auch Öle, werden zu Zuckern metabolisiert. Pektine,die den hauptsächlichen Bestandteil der Mittellamelle ausmachen, werden abgebaut. Die Früchte werden weich. Die Umsetzungen sind mit einer intensiven Zellatmung und einem hohen Sauerstoffverbrauch verbunden. In Trenngeweben ist der Ethylengehalt besonders hoch was schließlich die Abscission der Früchte zur Folge hat.
Weitere Prozesse, die von Ethylen reguliert werden, sind die Alterung und das Ausbleichen von Blüten, und die Abscission von Blütenblättern und von normalen Blättern. Die Blütenbildung wird durch Ethylen meist gehemmt. Bei den Ananasgewächsen (Bromeliaceen) dagegen findet man im Gegensatz zu allen anderen Pflanzengruppen eine Förderung der Blütenbildung durch Ethylen.
Ethylen ist auch der zentrale Regulator von Zelltodprogrammen in Pflanzen. In den Wurzel und manchmal auch in anderen Pflanzenorganen werden bei schlechter Versorgung mit Sauerstoff Hohlräume, sogenannte Aerenchyme, ausgebildet. Dies kann zum Beispiel in feuchten Böden bei Staunässe geschehen. Lysogene Aerenchyme entstehen dadurch, daß Zellen im Cortex der Wurzel einen programmierten Zelltod durchlaufen, der von Ethylern ausgelöst wird. Ebenfalls unter Ethylenkontrolle steht der programmierte Zelltod, den Endospermzellen während der Samenentwicklung bei Getreiden durchlaufen.
Schließlich führen sehr viele biotische und abiotische Stressfaktoren zur Ethylenbildung, wobei die physiologische Wirkung von Stressethylen sehr unterschiedlich sein kann. Ethylen kann in einigen Fällen die Kranheitssymptome verstärken, in anderen abschwächen oder ohne Wirkung bleiben.
Ethylen beeinflußt nicht nur im weiteren Sinne Seneszenzprozesse sondern auch Wachstum wie die asymmetrische Bildung des Hypokotylhakens von Dikotyledonen oder den horizontalen, agravitropen Wuchs der Sprossachse. Im allgemeinen hemmt Ethylen das Wachstum von terrestrischen Pflanzen.
Bei semiaquatischen Pflanzen dagegen beobachtet man eine Förderung des Sprosswachstums. H. KENDE (Michigan State University, USA; MÉTRAUX und KENDE, 1983; KENDE et al., 1998) wählte Reis (Oryza sativa L.) als Versuchsobjekt, um dieses Phänomen zu studieren, da gerade diese Kulturpflanze in vielen Anbaugebieten in tiefem Wasser wächst. Ethylen kann in Wasser nur sehr langsam diffundieren und reichert sich deshalb in überfluteten Pflanzenteilen an. Neben der Anreicherung von Ethylen durch verlangsamte Diffusion, kommt es zu einer erhöhten Ethylensynthese. Durch den niedrigen Sauerstoffpartialdruck im überfluteten Gewebe werden beide Enzyme der Ethylensynthese, ACC Synthase und ACC Oxidase, induziert. Die hohe Ethylenkonzentration bewirkt ihrerseits eine Zunahme der Gibberellinmenge und eine erhöhte Sensitivität des Internodialgewebes gegenüber Gibberellin. Gibberellin sorgt schließlich dafür, dass die Sprossachse im Bereich des jüngsten Internodiums anfängt sehr schnell (bis zu 25 cm pro Tag) zu wachsen. Dabei sind Teilungs- und Streckenwachstum jeweils um das dreifache gegenüber der Kontrolle erhöht. Ethylen ist somit ein Zwischenglied in der Wirkkette die vom Überflutungssignal zum Sprosswachstum führt.
In geschlossenen Räumen kann sich Ethylen anreichern. Reifende Früchte setzen Ethylen frei und stimulieren damit die spätreifen Früchte zu einer frühen Reife ("One rotten apple can ruin the whole basket"). Für die Lagerung von Früchten ist es wünschenswert, die Bildung oder die Verbreitung von Ethylen zu verhindern. In der Obstwirtschaft werden deshalb Früchte bei Unterdruck gelagert, um frei werdendes Ethylen zu entfernen. Umgekehrt werden Bananen im unreifen Stadium transportiert und gelagert und bei Bedarf mit Ethylen begast, um eine synchrone Reifung einzuleiten.
Um die Fruchtreife und das Ausbleichen von Blütenblättern zu kontrollieren, wurden auch biotechnologische Ansätze verfolgt. Bislang wurden zwei gentechnologische Strategien eingesetzt. Zum einen wurde versucht die Synthese von Ethylen in Tomaten zu hemmen. Dies wurde durch Gegenstrang- (Antisense) Expression von ACC Synthase oder ACC Oxidase erreicht. Auch die Verarmung des ACC Pools durch die Expression einer bakteriellen ACC Deaminase führte zu einer reduzierten Ethylenbildung. Zum zweiten wurde ein mutierter und damit defekter Ethylenrezeptor aus Arabidopsis in Tomate und in Petunie eingebracht. Dadurch konnte das Ethylensignal in der Pflanze nicht mehr weitergeleitet werden und es kam zu einer verspäteten Fruchtreife und zu einem verzögerten Ausbleichen der Blütenblätter, sowie zu verzögerter Abscission der Blüte.
|