1 Zwiebel
1 Kartoffel
etwas Weizenmehl
Rasierklingen (neu und ungebraucht)
1 Pinzette
1 - 2 Präpariernadeln
Präpariermesser
weichen Bleistift (Farbstifte, Kugelschreiber und vor allem Filzstifte sind zum Zeichnen denkbar ungeeignet und sollten im Praktikum nicht verwendet werden)
Radiergummi
weißes Zeichenpapier (DIN A4)
Objektträger
Deckgläser
etwas, was Sie sich schon immer mal unter dem Mikroskop ansehen wollten.
Mikroskop (Anleitung vor Gebrauch lesen !)
Glas Wasser
Spritzflasche mit destilliertem Wasser
Glasstab
Pasteurpipetten mit Hütchen
Reagenzglasgestell mit Reagenzgläsern
Papierhandtücher
Filterpapier
Kleenex - Tücher
1 m Kaliumrhodanidlösung
Jod- Jodkaliumlösung (Lugolsche Lösung) hergestellt nach folgender Vorschrift: 2 g Kaliumjodid und 1g Jod, gelöst in 300 ml destilliertem Wasser
1 Plastikspatel (Zahnstocher)
Erythrozytensuspension (Rote Blutkörperchen aus einer Blutkonserve)
physiologische Kochsalzlösung (NaCl : 0,9%ig)
2 Liter Becherglas (aus Kunststoff)
3 Färbeküvetten nach Hellendahl, gefüllt mit
1. Äther- Alkohol- Gemisch (1 : 1)
2. 1n HCl
3. Giemsa- Lösung (Stammlösung auf 2 % verdünnt)
Wasserbäder, eingestellt auf 60°C
| VORSICHT | |
|---|---|
| In diesem Experiment wird mit gefährlichen
Chemikalien umgegangen:
|
Wir behandeln Sie viel zu gut. Wir stellen Ihnen für die mikroskopischen Untersuchungen ein Präzisionsinstrument zur Verfügung, mit dem man mehr machen kann, als nur einige Objekte bei stärkerer Vergrößerung zu betrachten. Sie werden die Vorteile dieses Geräts aber erst dann voll zu würdigen wissen, wenn Sie es richtig zu bedienen gelernt haben und das wiederum setzt voraus, daß Sie auch in der Theorie verstanden haben, warum Sie den einen oder den anderen Handgriff tun müssen. Es gibt viele Einstellungen, die falsch sind, und als Folge davon Sie gar nichts erkennen, wenn Sie ins Mikroskop hineinschauen. Natürlich, je vielseitiger ein Gerät ist, desto mehr Fehler kann man machen.
Für jeden Einstellknopf und jede Linse gibt es Namen, die Sie lernen müssen, um sich über diese Dinge verständigen zu können.
In dem folgenden Diagramm und der dazugehörenden Legende sind die wichtigsten Teile beschrieben. Es handelt sich hierbei um ein Modell der Firma ZEISS. Im Prinzip sind die Geräte anderer Hersteller ähnlich aufgebaut.
Ein Mikroskop enthält 2 Linsensysteme: Okular und Objektiv. Jedes dieser Linsensysteme trägt zur Vergrößerung bei. Bei Ihren Geräten sind die Vergrößerungsfaktoren eingraviert, und zwar
![]() Okular 10 x
Okular 10 x
![]() Objektive: 3,2 x, 10 x, 40 x, 100 x
Objektive: 3,2 x, 10 x, 40 x, 100 x
Die Vergrößerung errechnet sich durch Multiplikation der Okular- und der Objektivvergrößerung.
Je näher man einen Gegenstand an das Auge führt, desto mehr Einzelheiten erkennt man, wobei man aber sehr schnell feststellt, daß es eine Grenze gibt, bei deren Unterschreiten das Auge den Gegenstand nicht mehr scharf abbilden kann, weil der Krümmungsradius der Augenlinse nur in bestimmten Grenzen verändert werden kann. Beim menschlichen Auge liegt diese Grenze, auch Bezugssehweite genannt, bei 250 mm.
Das Auge sieht den Gegenstand unter dem Sehwinkel G.
Beim Betrachten eines Gegenstandes interessiert uns, wie genau wir Einzelheiten erkennen können, mit anderen Worten, ob es uns gelingt, zwei benachbarte Punkte noch getrennt wahrnehmen zu können. Das Maß für die Unterscheidbarkeit zweier Punkte bezeichnet man als das Auflösungsvermögen.
Zum Betrachten kleiner Objekte, wie z.B. der Zellen, reicht das Auflösungsvermögen des Auges nicht aus. Wir brauchen deshalb optische Hilfsmittel. Das einfachste ist ein Vergrößerungsglas, eine Lupe, deren Vergroßerung berechnet man nach der Formel
V = 250 [mm] / f [mm]
Hierbei sind die 250 mm die Bezugsweite des menschlichen Auges und f die Brennweite der Linse. Kennt man die Vergrößerung einer Lupe, und möchte die Brennweite errechnen, so schreibt man die Formel um
f [mm] = 250 [mm] / V
Die nachfolgende Abbildung zeigt den Strahlengang bei Verwendung einer einfachen Linse.
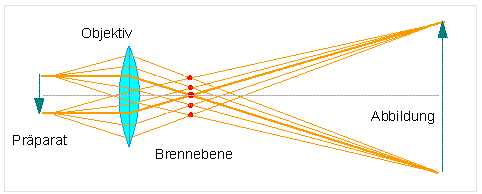
Einfache Lupen, die nur eine Linse bzw. ein Linsensystem enthalten, vergrößern bis zu ca. 20 oder 25fach. Möchte man Objekte stärker vergrößern, bedient man sich zweier Linsensysteme, und damit sind wir bereits beim Mikroskop.
Durch das Objektiv wird das Objekt (O) vergrößert; man erhält ein reelles umgekehrtes Zwischenbild (O'). Dieses Zwischenbild wird durch das Okular nachvergrößert. Man erhält O'', welches man als umgekehrtes Bild im Abstand von ca. 250 mm erkennt.

Somit sollte auch die eingangs gemachte Feststellung verständlich sein, warum sich die Vergrößerung eines Mikroskops aus der
Verg.obj x Vergr.ok
ergibt.
Wir haben bisher nur über Vergrößerung, aber nicht über Auflösung gesprochen. Für die Auflösung ist vor allem das Objektiv verantwortlich. Eine schlecht aufgelöste Struktur ist auch durch noch so starke Nachvergrößerung nicht besser zu erkennen. Sie kennen dieses Phänomen wahrscheinlich aus der Kleinbildphotographie.
Zur Beschreibung eines Objektivs genügt nicht nur der Vergrößerungsfaktor, sondern wir brauchen als weitere Größe die sogenannte numerische Apertur [A]. Darunter versteht man die Größe
A = n sin alpha
n ist der Berechnungsindex des Mediums zwischen Objekt (bzw. dem Deckglas) und der Frontlinse des Objektivs. In der Regel ist dieses Medium Luft und Luft hat den Berechnungsindex n = 1. alpha ist der Öffnungswinkel, unter dem ein Strahl vom Objektiv gerade noch aufgenommen werden kann. alpha kann niemals größer als 90° sein, somit kann die numerische Apertur niemals Werte über 1 annehmen. In der Praxis ist der Wert 0,95 die oberste Grenze; weil der Abstand zwischen Objektiv und der Deckglasoberfläche niemals den Wert 0 erreicht. Die Apertur von 0,95 entspricht einem Öffnungswinkel von ca. 72°.
Einen höheren Aperturwert erhält man, wenn man die Luft zwischen Objektiv und Deckglasoberfläche durch ein stärker brechendes Medium ersetzt. Hierzu hat sich das Immersionsöl mit dem Berechnungsindex : ny = 1,518 bewährt.
Es hat keinen Zweck, noch stärker brechende Komponenten einzusetzen, denn dann wäre der Brechungsindex des Deckglases und der Linsen der limitierende Faktor (ny = 1,525). Immersionsöl läßt sich nur bei speziell konstruierten Objektiven, den sogenannten Immersionsobjektiven, verwenden. Hierbei taucht das Objektiv in einen Öltropfen ein, den man auf das Deckglas aufträgt. Der Öffnungswinkel alpha kann hier maximal 67,5° betragen. Man erhält somit eine Apertur von 1,518 x 0,92 = 1,40.
Wenn wir die Apertur eines Objektives nunmehr kennen, können wir nach der Formel
d = lambda / 2 Aobj
das Auflösungsvermögen und somit die maximale sinnvolle Vergrößerung bestimmen. Wie die Formel schon auf den ersten Blick zeigt, spielt lambda, die Wellenlänge des Lichts, eine entscheidende Rolle. Ist lambda = 550 nm (= grünes Licht ), ergibt sich die folgende Beziehung zwischen dem Auflösungsvermögen und der Apertur:
d = 550 [nm] / 2 x 1,40 = ca. 200 nm = 0,2 µm
0,2 µm ist folglich die theoretisch maximale Auflösung, die man mit dem Mikroskop erreichen kann.
In grober Annäherung kann man sagen, daß das Auflösungsvermögen des Lichtmikroskops bei Verwendung eines starken Immersionsobjektives etwa bei der halben Lichtwellenlänge liegt. Kennt man die Auflösungsgrenze des Mikroskops, läßt sich auch die maximale sinnvolle (= förderliche) Vergrößerung bestimmen. Eine Vergrößerung ist nämlich nur dann förderlich, wenn die gerade aufgelösten Punkte (0,2 µm) so stark vergrößert werden, daß sie vom Auge im Abstand der (Bezugs-) Sehweite von 250 mm klar als getrennte Einheiten zu erkennen sind. In grober Annäherung kann man sagen, die förderliche Vergrößerung liegt bei
500 bis 1000 x Aobj
Also für ein Objektiv mit der Apertur 1,25 wie bei unseren Kursmikroskopen, bei ca. 1250fach.
Bei der normalen Lichtmikroskopie mit monochromatischem (= einfarbigem) Licht wird die Amplitude des Lichts beim Durchgang durch das Objekt verändert. In Abhängigkeit von der Objektstruktur wird das Licht somit mehr oder weniger stark abgeschwächt. Viele biologische Objekte erscheinen oft strukturlos. Zelle und Zellkern z. B. haben im sichtbaren Spektralbereich die gleiche Durchlässigkeit, so daß Helligkeits- und Farbunterschiede nicht wahrgenommen werden können. Der Zellkern ist optisch dichter als das Zellplasma, was bedeutet, daß Lichtwellen, die den Kern passieren, in ihrer Phase stärker zurückbleiben als Wellen, die das Plasma durchsetzen. Diesen Unterschied können wir nicht wahrnehmen, weil weder das Auge noch die photographische Platte derartige Unterschiede erkennen können. Beide registrieren nur Intensitätsunterschiede und Wellenlängenabhängigkeiten (= Helligkeit und Farbe), nicht jedoch Wellenzüge unterschiedlicher Phase.
Unterschiede zwischen z.B. Zellkern und Plasma lassen sich durch spezifische Färbungen darstellen, weil sie molekular unterschiedlich zusammengesetzt sind. Die Färbung ist eine chemische Umsetzung, als Folge derer gewisse Strukturen zerstört werden können. Man ist sich daher nie ganz sicher, ob das, was man sieht, reell oder ein Artefakt ist.
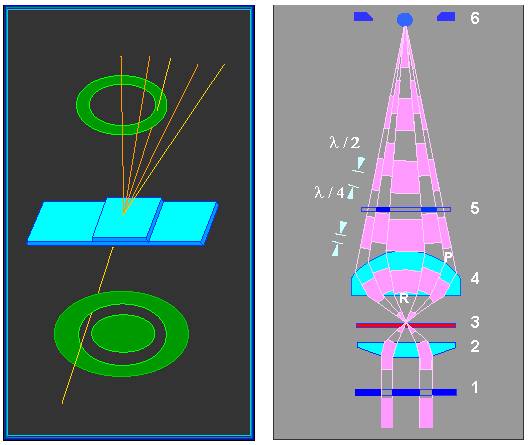
Einen Ausweg aus diesem Dilemma bietet das Phasenkontrastverfahren. Bei ihm wird durch Eingriff in den Strahlengang des Mikroskops die Phasenstruktur des Objektes in ein Amplitudenbild übersetzt. Technisch sieht das Verfahren so aus, daß man bei indirektem Licht arbeitet. Durch eine Blende unterhalb des Kondensors wird das direkte Licht abgefangen. Nur ein Lichtring erreicht somit das Objekt. Um zu verhindern, daß dieses Licht direkt in das Mikroskop eindringt, enthält ein Phasenkonstraktobjektiv eine ringförmige Blende, (einen schwarzen Ring ) an der unteren Seite der Objektivlinse. Bei Ihren Mikroskopen ist nur das 40er Objektiv ein Phasenkontrastobjektiv. Sie können es erkennen, wenn Sie das Objektiv vorsichtig herausdrehen und es gegen das Licht halten. Die Blende unter dem Kondensor wird von einem Halter getragen. Achten Sie darauf, daß diese Halterung stets herausgeklappt wird, wenn Sie im normalen Verfahren mikroskopieren wollen.
Durch die Blende im Strahlengang tritt nur indirektes, am Objektiv gebeugtes, Licht ins Mikroskop. Bei dieser Lichtbeugung werden die Phasenverschiebungen, die beim Durchtritt durch das Objekt auftreten, in Amplitudendifferenzen verwandelt. Als Folge davon erkennt man eine Verstärkung von Helligkeitsunterschieden und somit eine Kontrastierung der Strukturen. Zellplasma und Zellkern z. B. sind auf diese Weise sehr leicht voneinander zu unterscheiden, darüberhinaus erkennt man eine Reihe weiterer Strukturen im Plasma, die bei normaler Lichtmikroskopie unerkannt bleiben.
Okular und Objektive kennen Sie bereits. Jedes Okular kann mit Hilfe des Revolvers in den Lichtweg gebracht werden. Am Objekttisch finden Sie einen Kreuztisch, in den Sie den Objektträger einspannen können und mit dem Sie das Präparat in beide Richtungen verschieben können.
Grundsätzlich sind folgende Regeln zu beachten
Präparat erst bei schwacher, dann erst bei starker Vergrößerung betrachten. Die Längen der Objektive sind so aufeinander abgestimmt, daß die Bildschärfe beim Objektivwechsel nicht verloren geht. Geringer wird natürlich bei stärkeren Objektiven die Tiefenschärfe.
Stellen Sie Ihr Präparat zunächst mit dem Grobtrieb (großes Rad seitlich am Mikroskop) + / - scharf ein. Führen Sie den Objekttisch so nahe wie möglich an das Objektiv heran. Verfolgen Sie diesen Vorgang durch Beobachtung von der Seite. Ein Zusammenstoß zwischen Objektiv und Objekt ist zu vermeiden. Beim Beobachten des Präparats nur den Feintrieb (kleines Rad) verwenden, oder den Grobtrieb verwenden, um den Abstand zwischen Objektiv und Präparat zu vergrößern.
Kondensor (Linsensystem unterhalb des Objekttisches) so weit nach oben drehen wie möglich. Die "Frontlinse" (die dem Objekt am nächsten liegt), bei kleinen Vergrößerungen (3,2 x, 10 x) aus dem Lichtweg herausklappen. Sie nur bei stärkeren Vergrößerungen verwenden.
Die Beleuchtungsstärke darf nicht zu hoch sein. Sie ist durch einen Widerstand am Lampengehäuse regulierbar. Die Helligkeit ist im Schnitt gerade richtig, wenn die beiden weißen Markierungslinien zur Deckung kommen.
Leuchtfeldblende (Blende an der Lichtquelle) offen lassen.
Aperturblende (Blende am Kondensor) nur so weit schließen, bis Sie optimalen Kontrast erhalten. Bei weiterem Schließen beeinflussen Sie den Aperturwinkel und somit die Auflösung. Sie können die Einstellung wie folgt vornehmen: Objektiv 3,2 einstellen, Blende soweit schließen, daß sie gerade nicht mehr abgebildet wird. Bei weiterem Schließen erscheint der Rand des Bildes dunkel.
- Halterung mit Phasenkontrastblende in der Regel aus dem Lichtweg herausdrehen.
Arbeiten mit Phasenkontrast: Phasenkontrastblende in den Lichtweg bringen. Aperturblende + / - ganz öffnen, Leuchtstärke der Lampe erhöhen. Phasenkontrast erhalten Sie nur mit den dafür geeigneten Objektiven. Bei den Kursmikroskopen ist es nur das 40er Objektiv. Bei Verwendung anderer Objektive erhalten Sie keinen Phasenkontrast, sondern ein "Dunkelfeld", d.h. Sie erkennen helle reflektierende Strukturen Ihres Objekts auf dunklem Untergrund. (Es gibt in der Biologie Einsatzmöglichkeiten für diese sogenannte "Dunkelfeldmikroskopie": In der Regel ist aber die Hellfeldmikroskopie von Vorteil.)
Das Immersionsobjektiv werden wir in diesem Praktikum gelegentlich einsetzen. Man erhält hier ein klares Bild nur unter Verwendung von Immersionsöl. Versuche, ohne Öl damit zu arbeiten, sind zwecklos.
Optimale Ausleuchtung erhält man nur dann, wenn die Lichtquelle bzw. der Kondensor in der Optischen Achse liegt. Alle Kursgeräte haben wir daraufhin justiert. Sie können alles verderben, wenn Sie an den kleinen Justierrändelschrauben am Kondensor drehen, - also: Finger weg davon, oder sich zeigen lassen, wie man ein dejustiertes Gerät wieder justiert.
- Das Präparat:
a ) Präparat stets mit einem Deckglas abdecken. Auf der Oberseite des Deckglases darf nie Wasser stehen. Sollte das trotzdem einmal der Fall sein, so muß es mit einem Stück Filterpapier entfernt werden, bevor Sie das Präparat auf den Objekttisch legen. Sollte, was noch schlimmer ist, ein Objektiv befeuchtet worden sein, so ist es umgehend mit einem weichen Tuch [Kleenex] wieder zu reinigen.
b) Das Pärparat muß stets in Flüssigkeit eingebettet sein. Achten Sie darauf, daß keine Luftblasen unter das Deckglas geraten, wenn Sie Ihr Präparat damit bedecken. Stark lichtbrechende, meist runde Strukturen, die fast jeder Anfänger am ersten Praktikumstag im Mikroskop erkennt, sind Luftblasen, die bei sorgfältigem Arbeiten eigentlich nicht auftreten sollten.
c ) Die Unterseite des Objektträgers soll genau so trocken sein wie die Oberseite des Deckglases. Feuchtigkeitsspuren auf dem Objekttisch sind umgehend zu entfernen.
Über alle durchgeführten Versuche ist ein ausführliches Protokoll zu führen. Es soll korrekt, vollständig und übersichtlich sein. Es dient dem Zweck, daß Sie selbst oder jemand anderer(es) die Versuche zu einem späteren Zeitpunkt nachvollziehen können.
Versuche ohne eine gewissenhafte Protokollführung sind eine Zeit- und Geldverschwendung.
Die folgende Gliederung kann als Richtlinie zum Aufbau eines Protokolls herangezogen werden.
- Überschrift (Titel), Bezeichnung des Experimentes. Name und Platznummer des Experimentators, Datum.
- Einleitung: Kurze Darlegung der Fragestellung (Stichworte sind oft ausreichend); gegebenenfalls Nennung verwendeter Literaturstellen.
Material und Methoden: Herkunft des Versuchsmaterials, Mikroskopie: Angabe, bei welcher Vergrößerung Sie gearbeitet haben. Alle Einzelheiten des Experiments, insbesondere Einwaagen, Volumina, Temperaturen, kinetische Daten, Blindwerte, Chromatogramme, Rechnungen (mit Zwischenwerten !) usw. Die Daten sind übersichtlich anzuordnen (Details nicht vergessen), damit sich der Verlauf des Experiments bis in die Einzelheiten verfolgen läßt. Nur so können bei Mißerfolgen die Fehler gefunden werden. Auch fehlgeschlagene Experimente sind in der gleichen Weise aufzuführen. Es ist selbstverständlich überflüssig, Dinge abzuschreiben, die in einer vorliegenden Versuchsanleitung beschrieben sind. Nur dann, wenn Sie von der Vorschrift abweichen, muß die experimentelle Durchführung genau beschrieben werden.
Ergebnisse Meßwerte sind in Form von Tabellen, Diagrammen u.s.w. übersichtlich zusammenzustellen. Gegebenenfalls ist eine Fehlerrechnung durchzuführen.
Beobachtete Strukturen - makroskopisch oder mikroskopisch - sind zeichnerisch darzustellen. Zeichnen Sie grundsätzlich nur mit einem Bleistift. Verwenden Sie weißes, glattes Papier. Gewöhnen Sie es sich an, Linien glatt durchzuziehen (dünn vorzeichnen, dann verstärken). Stricheln, ,,schummern", wischen u.s.w. ist zu vermeiden. Radieren ist erlaubt (und meist unumgänglich - deshalb nur mit Bleistift zeichnen).
Die Rückseiten der Zeichenblätter sollen nicht benutzt werden.
Die Zeichnungen sollen möglichst groß sein, damit sie genügend Details einzeichnen können. Sie sollten etwa 2/3 bis 3/4 des zur Verfügung stehenden Raumes einnehmen, so daß oben und unten noch Platz für die Beschriftung bleibt. Die Zeichnungen sind grundsätzlich an Ort und Stelle durchzuführen.
Wir befinden uns in einem naturwissenschaftlichen Institut, nicht in einer Kunstakademie. Es kommt auf die Wiedergabe von Tatsachen an, künstlerische Freiheit wird nicht honoriert. Zu Hause angefertigte Zeichnungen sind wertlos ! Zeichnen Sie, was Sie sehen und nicht das, was in Lehrbüchern dargestellt ist.
Bei Strukturen, die aus vielen gleichartigen Elementen aufgebaut sind (etwa ein Stengelquerschnitt, der viele ähnlich gebaute Zellen enthält), sind nur Ausschnitte zu zeichnen.
In einer Übersichtszeichnung soll angedeutet werden, wo welche Elemente liegen. Ein Übersichtsbild eines Stengelquerschnitts z. B. soll die Anordnung der Leitbündel zeigen.
Ein Detailbild eines Leitbündels soll die Form und relative Größe der Zellen enthalten. Achten Sie vor allem auf die Proportionen.
5. Diskussion
Ein Protokoll schließt mit einer Zusammenfassung der Ergebnisse, mit einer "Diskussion" der Ergebnisse, einer Erklärung, sowie gegebenenfalls einer Deutung, warum der eine oder der andere Versuch fehlschlug. Sie können weiterhin aufführen, welche Zusatzversuche denkbar wären, um weitere Fragen zu beantworten. Auch Kritik am Versuchsaufbau und der Wahl des Versuchsobjekts ist angebracht.
Welche Schlüsse können aus den Ergebissen gezogen werden? Wurden die eingangs gestellten Fragen befriedigend beantwortet, oder sind die Ergebnisse nicht schlüssig? Übrigens: Es ist international üblich, daß wissenschaftliche Originalveröffentlichungen nach dem oben genannten Schema abgefaßt werden (Einleitung, Material und Methoden, Ergebnisse, Diskussion, Zusammenfassung, Literaturzitate)
Zusammenarbeit ist erwünscht. Es dürfen gemeinsam erarbeitete Protokolle (gleichen Wortlauts) abgegeben werden. Es ist jedoch darauf zu achten, daß jeder Teilnehmer für sich eine Kopie erhält.
Eine Bemerkung dazu
Photokopieren ist billiger als Abschreiben. Abschreibeiben ist stets verlorene Zeit.
Leichter geht es nicht. Übertragen Sie die Epidermis der Zwiebelschuppe auf einen Objektträger, auf den Sie vorher einen Tropfen Wasser gegeben haben. Legen Sie vorsichtig ein Deckglas darauf. Achten Sie bitte darauf, daß sich keine Luft zwischen Präparat und Deckglas ansammelt (meist läßt es sich nicht ganz vermeiden).
Beim Mikroskopieren: Bei Berührung von Objektiv und Deckglas droht Bruchgefahr des Deckglases. Viel schlimmer sind hierbei jedoch Kratzspuren an der Objektivlinse.
Betrachten Sie Ihr Präparat erst bei 32facher, dann bei 100facher Vergrößerung. Eine 100fache Vergrößerung ist für viele der Fragen, die wir an diesem Präparat untersuchen wollen, ausreichend.
| Wie sehen die Zellen aus? Verhältnis Länge / Breite. Form ? | |
| Wie dick ist die Zellwand im Vergleich zur Zelle? | |
| Was sieht man im Inneren der Zelle? | |
| Können Sie den Zellkern erkennen? Wenn ja, wo liegt er? Wie groß ist er im Vergleich zur ganzen Zelle? |
Stellen Sie eine Zeichnung Ihrer Beobachtungen her.
Verwenden Sie zum Zeichnen nur einen weichen Bleistift, damit Sie auch noch radieren können. Teilen Sie den Platz auf einer Seite (weißes Papier, unliniert, DIN A4) ein. Die Zeichnung soll nicht zu klein sein, sie soll alle Details enthalten, die Sie beim Mikroskopieren sehen - aber keine Artefakte.
Eine Struktur, die Sie nur bei einer Zelle erkennen, ist mit ziemlicher Sicherheit ein Artefakt oder irgendeine Verunreinigung.
Nicht alle Präparate sehen gleich aus. Sehen Sie sich z.B. auch einmal die Epidermiszellen der jüngsten Zwiebelschuppe an.
![]() Sehen Sie einen Unterschied?
Sehen Sie einen Unterschied?
Betrachten Sie Ihr Präparat auch bei 400facher Vergrößerung.
![]() Wie ist das Plasma in der Zelle verteilt?
Wie ist das Plasma in der Zelle verteilt?
![]() Ist die Zellwand eine einheitliche Struktur, oder besitzt sie Durchlässe?
Ist die Zellwand eine einheitliche Struktur, oder besitzt sie Durchlässe?
Durchlässe durch pflanzliche Zellwände bezeichnet man als Tüpfel, die durch sie hindurchreichenden Plasmastränge Plasmodesmen.
Betrachten Sie das Präparat im Phasenkontrast.
![]() Sehen Sie mehr als vorher?
Sehen Sie mehr als vorher?
Sie können Ihr Präparat auch färben. Saugen Sie einen Tropfen Lugolscher Lösung (Jod- Jodkalium) durch Ihr Präparat.
![]() Welche Strukturen färben sich und wie?
Welche Strukturen färben sich und wie?
Stellen Sie ein neues Präparat her. Saugen Sie einen Tropfen Kaliumrhodanid hindurch.
![]() Was erkennen Sie (100fache Vergrößerung)?
Was erkennen Sie (100fache Vergrößerung)?
![]() Erkennen Sie das Plasma?
Erkennen Sie das Plasma?
![]() Die Vakuole? (Skizze anfertigen)
Die Vakuole? (Skizze anfertigen)
Dann Kaliumrhodanid mit Wasser wieder auswaschen.
Bei Zugabe einer Lösung, die konzentrierter als der Plasma- und Vakuoleninhalt ist, wird letzteren Wasser entzogen. Sie beginnen zu schrumpfen: Plasmolyse. Wasserzugabe zeigt, daß die Schrumpfung reversibel ist.
Eine Lösung, die konzentrierter als das Plasma ist, nennt man hypertonische Lösung. Eine gleich konzentrierte Lösung eine isotonische Lösung und eine schwächer konzentrierte eine hypotonische. In einer hypotenischen Lösung nimmt der Zellinhalt Wasser auf, bis die Konzentration im Inneren den gleichen Wert erreicht wie die Umgebung.
Hierzu machen wir folgenden Versuch: Sie finden auf Ihrem Platz eine Erythrozytensuspension (rote Blutkörperchen aus einer alten Blutkonserve). Verdünnen Sie einen Teil der Suspension mit destilliertem Wasser.
Setzen Sie ein% Kontrolle an: Verdünnung mit physiologischer (= 0,9 %iger) NaCl- Lösung (NaCl = Kochsalz).
| Haben Sie sich einmal eine Bockwurst warmgemacht? (Was hat diese Frage mit dem bisher gesagten zu tun?) | |
| Unterschied? | |
| Schauen Sie sich die Erythrozyten unter dem Mikroskop an? | |
| Welche Form haben sie? | |
| Wie groß sind sie im Vergleich zu den Zwiebelzellen? | |
| Haben Sie einen Zellkern? | |
| Haben sie eine Zellwand? |
Pflanzenzellen werden durch reines Wasser nicht geschädigt.
![]() Haben Sie eine Erklärung hierfür?
Haben Sie eine Erklärung hierfür?
Zellen können eine Reihe von Substanzen speichern: Eiweiß, Kohlenhydrate, Fette. Pflanzen können Kohlenhydrate in Form von Stärke speichern.
| Können Sie es sich erklären, warum meist Makromoleküle
und nicht niedermolekulare Substanzen, z. B. Zucker gespeichert werden? |
|
| Welche pflanzlichen Zellen enthalten besonders viel niedermolekularen Zucker? |
Stärke findet man in Form von Stärkekörnern. Ihre Form ist für jede Pflanzenart charakteristisch. Im Praktikum beschränken wir uns darauf, die Stärkekörner der Kartoffel, sowie von Weizen zu untersuchen.
Stellen Sie mit einer Rasierklinge einen Dünnschnitt durch ein Kartoffelstück her und beobachten Sie es unter dem Mikroskop.
![]() Erkennen Sie Zellwände?
Erkennen Sie Zellwände?
![]() Erkennen Sie Stärkekörner?
Erkennen Sie Stärkekörner?
![]() Wie groß sind die Stärkekörner im Vergleich zur Zelle?
Wie groß sind die Stärkekörner im Vergleich zur Zelle?
![]() Sind sie alle gleich groß?
Sind sie alle gleich groß?
![]() Wieviel Stärkekörner findet man etwa in einer Zelle?
Wieviel Stärkekörner findet man etwa in einer Zelle?
Färben Sie Ihr Präparat mit wenig (!) Jod - Jodkaliumlösung an.
![]() Wie färbt sich Stärke?
Wie färbt sich Stärke?
![]() Was geschieht, wenn Sie zu viel Jod - Jodkalium hinzugeben?
Was geschieht, wenn Sie zu viel Jod - Jodkalium hinzugeben?
Betrachten Sie die Struktur eines Stärkekorns in ungefärbtem oder nur leicht gefärbtem Zustand
![]() Sehen Sie Unterstrukturen?
Sehen Sie Unterstrukturen?
![]() Wie sehen sie aus?
Wie sehen sie aus?
Können Sie sich vorstellen, daß diese Strukturen etwas mit der Bildung von Stärkekörnern zu tun haben?
![]() Zeichnen Sie, was Sie beobachtet haben.
Zeichnen Sie, was Sie beobachtet haben.
Nachdem Sie wissen, wie Kartoffelstärke aussieht, schauen Sie sich das mitgebrachte Weizenmehl an. Färben Sie es mit Jod - Jodkaliumlösung an.
Stellen Sie eine Suspension von Stärke in Wasser her (im Reagenzglas) und geben Sie einen Tropen Jod - Jodkaliumlösung hinzu. Was geschieht ?
Lassen Sie die Probe einige Zeit stehen. Setzen Sie eine zweite Probe dieser Art an. Fügen Sie einige Milliliter Speichel hinzu. Beobachten Sie die Färbung in beiden Gläschen nach einiger Zeit.
Wenn Sie einen Unterschied finden
![]() Worauf führen Sie ihn zurück?
Worauf führen Sie ihn zurück?
Wie schon in der Einleitung angedeutet, ist es ohne geeignete Hilfsmittel relativ schwierig, Zellen tierischer Gewebe sichtbar zu machen. Zu den Ausnahmen gehören die Zellen der Mundschleimhaut. Es handelt sich hierbei um epidermale Zellen, die ständig neu gebildet und imer wieder abgestoßen werden. Viele Zellen dieses Abschlußgewebes stehen nur noch in lockerem Kontakt mit dem Gewebe, aus dem sie entstanden. Sie sind deshalb durch Abkratzen sehr leicht zu gewinnen.
Schaben Sie (nicht zu zaghaft !) mit dem Plastikspatel von der Mundschleimhaut Zellen heraus und verstreichen Sie sie in der Mitte des Objektträgers. Auf dem Objektträger soll eine relativ dicke graue Schicht zu erkennen sein.
- Lassen Sie diesen Ausstrich kurz trocknen und fixieren Sie ihn durch Eintauchen in das Äther - Alkohol - Gemisch (30 min.)
- Überführen Sie den Objektträger in in HCl (2 min. stehenlassen). Stellen Sie das Glas mit der in HCl und den darin befindlichen Objektträgern für 10 min. in das 60° Wasserbad.
- abkühlen lassen.
- Wässern Sie das Präparat (dafür steht das 2 Liter Becherglas zur Verfügung).
- Färben Sie das Präparat in der Giemsalösung (10 min).
- Waschen Sie es mit Wasser.
- Trocknen Sie den Objektträger auf einem Papierhandtuch und betrachten Sie anschließend Ihr Präparat im Mikroskop.
Welche Form haben die Zellen ?
Da das Zellplasma durch die Giemsa - Färbung nicht gefärbt ist, erscheinen seine Grenzen unscharf. Betrachten Sie Ihr Präparat deshalb auch im Phasenkontrastmikroskop. Wiederholen Sie Ihre Beobachtungen an lebenden Zellen (Ausstrich in einem Wassertropfen suspendieren, Deckglas drauf und unter's Mikroskop).
Zurück zu den gefärbten Zellen. Der Kern ist deutlich gefärbt, auffallend sind Unterstruktuen des Kerns, das Chromatin.
Bei Frauen findet man im Kern eine intensiv dunkelblau gefärbte kleine Struktur, das BARRsche Körperchen. Das eben beschriebene Verfahren ist deshalb auch zur Geschlechtsbestimmung anwendbar. Der sogenannte "Haarwurzeltest" beruht auf genau dem gleichen Vorgang.
Auch an Haarwurzeln werden ständig Zellen abgestoßen, die leicht zu gewinnen sind. Das Färbeverfahren unterscheidet sich nicht von dem hier beschriebenen; es gibt natürlich Labors, in denen Varianten verwendet werden. Die Ergebnisse sind + / - gleich, aber jeder schwört auf das Verfahren, welches er gelernt hat und ständig anwendet: Macht der Gewohnheit. Sie können selbst entscheiden, was vorteilhafter ist: Zellen der Mundschleimhaut oder Zellen der Haarwurzel zu untersuchen.