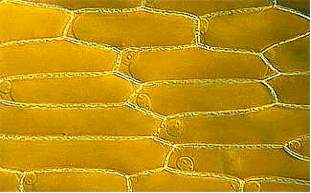
Die Epidermis ist das Abschlußgewebe aller oberirdischen Organe gegenüber ihrer Umwelt. Die Zellen der Zwiebelepidermis sind Standardobjekte am ersten Kurstag eines jeden botanisch-mikroskopischen Anfängerpraktikums. Da sie kein Chlorophyll enthalten, dürfte man sie eigentlich gar nicht als "typische" Pflanzenzellen heranziehen.
Zellen in Verbänden sind langgestreckt, das Längen-/Breitenverhältnis kann in recht weiten Grenzen schwanken. Jede Zelle ist von einer in sich geschlossenen Wand umgeben. Vor allem im Bereich der Zellpole (Spitzen) oder dort, wo drei Zellen aneinanderstoßen, bleibt ein extrazellulärer Interzellularraum ausgespart. Ansonsten ist zwischen aneinanderliegenden Zellen eine pektinhaltige Mittellamelle ausgebildet, die den Zusammenhalt der Zellen und damit die Bildung von Geweben gewährleistet. In regelmäßigen Abständen ist die Zellwand durchbrochen (perforiert), so daß die Zellinhalte untereinander Kontakt aufnehmen können. Die Aussparungen in der Wand heißen Tüpfel, die durch sie hindurchlaufenden Plasmastränge Plasmodesmen. Die Oberseite der Epidermiszellen sieht unregelmäßig faltig aus. Die Ursache hierfür ist eine wasserabstoßende, wachsartige Auflagerung, die Kutikula.
Der von einer Membran (Plasmamembran oder Plasmalemma) umgebene "lebende" Zellinhalt ist das Plasma (= Protoplasma). Man nennt es auch den Protoplasten. Meist liegt dieser der Zellwand so eng an, daß die umgrenzende Membran nicht wahrgenommen werden kann. Um deren Existenz nachzuweisen, überträgt man die Zellen zweckmäßigerweise in ein Medium hoher Salz- (oder Zucker)- konzentration. Dabei schrumpft der Protoplast und löst sich von der Wand. Der Vorgang ist reversibel und wird Plasmolyse genannt; die Umkehr des Prozesses ist die Deplasmolyse. Die Ursache für die Formveränderungen ist in den Membran- und Plasmaeigenschaften zu suchen. Dazu seien hier nur die Stichworte Semipermeabilität, Osmose und Turgor (osmotischer Druck) vermerkt. Eine die Plasmolyse hervorrufende Substanz wird Plasmolytikum genannt, und je nach ihrer chemischen Zusammensetzung (z.B. Kaliumionen oder Calciumionen) nimmt der Protoplast unterschiedliche, doch charakteristische Gestalt an. Daraus wiederum folgt, daß das Plasmolytikum die Membraneigenschaften beeinflußt. Es wird auch deutlich, daß sich die Eigenschaften des Plasmalemmas von denen des Tonoplasten unterscheiden. Der Tonoplast ist die Membran, die die Vakuole umschließt. Der Unterschied ist vor allem dann augenscheinlich, wenn Zellen mit gefärbtem Vakuoleninhalt verwendet werden. Oft ist die Vakuole von zahlreichen Plasmasträngen durchzogen, deren Vorkommen darauf hinweist, daß wir das Plasma nicht als eine einfache Lösung betrachten dürfen, die allein den Regeln der Hydrodynamik gehorcht. Vielmehr enthält es viskose, strukturbestimmende Komponenten, deren chemische, physikalisch-chemische und strukturelle Eigenschaften erst in den letzten Jahren und dazu erst bruchstückweise erkannt worden sind.
Der Zellkern ist ein auffallender Bestandteil nahezu aller lebenden Pflanzenzellen . Die Struktur des Kerns ist gegen das übrige Plasma abgesetzt, er ist von einer Hülle (nach elektronenmikroskopischen Untersuchungen einer Doppelmembran) umgeben. Für den Kerninhalt wurde der Begriff Karyoplasma, für das restliche Plasma der Ausdruck Cytoplasma geprägt. Solche Begriffe gelten allerdings nur während bestimmter Phasen im Lebenszyklus einer Zelle. Im Verlauf der Zell- und Kernteilung (Mitose) nämlich löst sich die Kernmembran auf, wodurch die Struktur des Kerns verlorengeht, an seine Stelle treten die Chromosomen. Während dieser Phase ist es natürlich nicht sinnvoll, von Karyo- und Cytoplasma zu sprechen.
Die Kerne pflanzlicher Zellen sind in der Regel rund oder elliptisch, gelegentlich auch spindelförmig. Normalerweise findet man einen Kern pro Pflanzenzelle, doch sind Zellen mit zwei Kernen keine zu seltenen Ausnahmen. Die Zellen einiger Algen, z.B. die aus der Gattung Cladophora sind vielkernig oder polyenergid. Als Unterstrukturen des Zellkerns fallen (oft erst nach Färbung) ein oder mehrere Nukleoli auf. Auch sie disintegrieren während der Zell- und Kernteilung und bilden sich erst im Anschluß an eine erneute Kernbildung wieder.
Plastiden sind typische Organellen der Pflanzenzellen. Zu ihnen gehören die bereits genannten Chloroplasten. Daneben aber auch noch andere, wie die farbigen Chromoplasten und die farblosen Leukoplasten, sowie Übergangsstadien (Proplastiden). Jene wiederum sind rudimentäre (zurückgebildete) Formen, die z.B. bei der Eizellbildung durch Degeneration von Plastiden entstehen. Während der pflanzlichen Embryonalentwicklung können sie sich wieder zu vollständigen Plastiden differenzieren. Eine Ergrünung, und damit die Umwandlung in Chloroplasten, erfolgt bei den meisten höheren Pflanzen jedoch nur nach Belichtung.
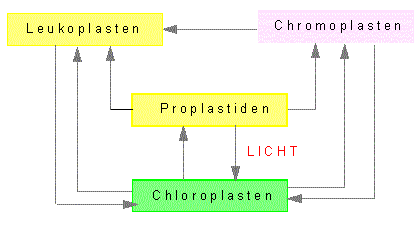
Übergänge zwischen den einzelnen Plastidentypen. Zur Bildung der Chloroplasten wird Licht benötigt; die Rückbildung zu Proplastiden erfolgt über mehrere Zwischenstufen im Verlauf der Differenzierung bestimmter Zelltypen (z. B. der Eizellen) (Nach T. BUTTERFAß, 1970).
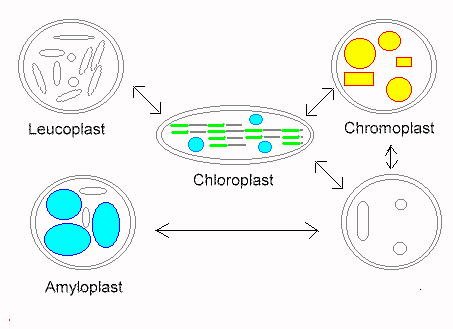
© M. Knee
Chloroplasten. Chloroplasten sind Träger des grünen Pflanzenfarbstoffs Chlorophyll. In ihnen laufen die Reaktionen der Photosynthese ab. Durch sie werden die Pflanzen in die Lage versetzt, Sonnenenergie in chemische Energie umzusetzen. Pflanzen gelten daher als Primärproduzenten, von deren Existenz die der Konsumenten (vorwiegend also der Tiere) abhängt. Chloroplasten kommen in vielen Zelltypen oberirdischer Organe vor. Besonders leicht lassen sie sich in einschichtigen Geweben, so in den Blättchen einiger Moose, wie Funaria hygrometrica oder Mnium hornum oder einer Wasserpflanze (Vallisneria) beobachten. Hier sind sie relativ groß, ihre Gestalt ist linsenförmig. Bei diffusem Tageslicht liegen sie vornehmlich an der oberen und unteren Fläche der Blätter. Man sieht sie daher in der Aufsicht, und sie erscheinen als runde Strukturen. Bei starker Belichtung verlagern sie sich und nehmen eine Stellung parallel zu den Seitenwänden ein, wobei sie im Profil schmäler erscheinen.
In Chloroplasten wird Stärke gebildet und gespeichert. Sie ist mit Jod-Jodkalium (Lugolsches Reagenz) leicht nachweisbar. Der Komplex Stärke - Jod ist blau gefärbt.
Die Stärkebildung im Verlauf des Photosyntheseprozesses kann, wie J. v. SACHS - der wohl profilierteste Pflanzenphysiologe des vergangenen Jahrhunderts, erstmals zeigte, in einem Experiment sichtbar gemacht werden, in dem ein Blatt durch eine Schablone teilweise abgedeckt wird, so daß es nur partiell dem Sonnenlicht ausgesetzt ist. Nach Ablauf eines Tages wird das Blatt zunächst gebleicht, um die Störung des Stärkenachweises durch Chlorophyll und andere Pigmente auszuschalten und anschließend in eine Jod-Jodkaliumlösung gelegt. Man erhält - einer Photographie vergleichbar - das Abbild der Schablone als Verteilungsmuster von Stärke im Blatt.
J. v. SACHS nahm an, die Stärke sei das primäre Produkt der Photosynthese. Diese Annahme erwies sich jedoch als falsch, denn es werden zunächst einfache Zucker (Glucose u.a.) gebildet, von denen lediglich ein Teil zu Stärke polymerisiert wird.
Die Gestalt der Chloroplasten in Zellen höherer Pflanzen ähnelt weitgehend der in Moosen. Ihr Durchmesser beträgt durchschnittlich 4-8 µm. Ihre Zahl liegt in der Größenordnung von 10-50 pro Zelle. Das Chlorophyll ist in ihnen ungleichmäßig verteilt. Bei hoher Auflösung lassen sich chlorophyllreiche und chlorophyllarme Bereiche (Grana und Stroma) voneinander unterscheiden. Anregung mit kurzwelligem Licht (z.B. blauem oder violettem Licht) führt zu einer intensiven, leuchtend roten Eigenfluoreszenz (Autofluoreszenz) des Chlorophylls, die in einem Fluoreszenzmikroskop eindrucksvoll demonstriert werden kann. Hierbei treten die Unterschiede zwischen den Grana und dem Stroma besonders deutlich hervor. Die Gleichförmigkeit der Chloroplastenstruktur bei allen höheren Pflanzen weist darauf hin, daß die optimale Form in Verlauf der Evolution schon recht früh gefunden und seitdem nicht geändert wurde. Anders sieht es bei den Algen aus. Chloroplasten der Grünalgen (Chlorophyceen) sind vielgestaltig. Viele Arten besitzen nur einen, oft nahezu das gesamte Plasma der Zelle erfüllenden Chloroplasten. Er ist bei Spirogyra-Arten schraubenförmig gewunden, bei Zygnema und Zygnemopsis sternförmig und bei Oedogonium netzförmig strukturiert.
Den plattenförmigen Mougeotia Chloroplasten kann man je nach Lichtmenge in Flächen- oder Kantenstellung beobachten. Seine Drehung ist ein experimentell gut analysiertes Beispiel einer induzierten Chloroplastenbewegung. Die Chloroplasten vieler Algen verfügen - im Gegensatz zu den weitaus meisten der höheren Pflanzen - über deutlich sichtbare Pyrenoide, in denen Stärke gebildet und gespeichert wird.
Chromoplasten. Chromoplasten sind farbige (gelbe, orange oder rote) Plastiden. Die Färbung beruht in der Regel auf der Anwesenheit von gelbem Xanthophyll und gelben bis roten Carotinoiden. Beide Stoffklassen kommen auch in den Chloroplasten vor, sind dort aber durch Chlorophyll überdeckt. Daß Chlorophyll aber schneller als die Carotinoide abgebaut wird, erkennt man im Herbst an der Laubfärbung. Es gibt fließende Übergänge zwischen Chromo- und Chloroplasten, ebenso wie es Übergänge zwischen Chromoplasten und Leukoplasten gibt. Typische Chromoplasten verursachen die Orangefärbung der Möhre, die Rotfärbung der reifen Paprika- und Tomatenfrüchte sowie die Färbung zahlreicher, doch bei weitem nicht aller Blüten. Die Carotinoide sind schwer wasserlöslich und kristallisieren daher in den Chromoplasten oft aus, wobei die Kristalle unterschiedliche Formen annehmen können: platten- oder nadelförmig, gezackt, sichelförmig usw.
In vielen Fällen wird die Blütenfarbe und / oder die Farbe der Blätter durch gefärbten Vakuoleninhalt verursacht. Die Farbe des Vakuoleninhalts und die Farbe der Plastiden kann zu Mischfarben führen. Das typische Beispiel: die Blätter der Blutbuche (der Vakuoleninhalt ist rot, die Chloroplasten grün). Den Chromoplasten rechnet man traditionsgemäß auch die Plastiden der Rot- und Braunalgen zu, obwohl sie Chlorophyll enthalten. Die grüne Farbe wird durch das rote Phycoerythrin (bei Rotalgen, Rhodophyceae), bzw. das braune Fucoxanthin (bei Braunalgen, Phaeophyceae) überdeckt.
Leukoplasten. Leukoplasten sind weitverbreitete, farblose Plastiden. Sie entstehen aus Proplastiden, stellen aber keine homogene Organellengruppe dar. Eine Teilpopulation kann sich bei Belichtung zu Chloroplasten oder Chromoplasten differenzieren, für andere wiederum trifft dies nicht zu. So findet man in den Nebenzellen der Schließzellen regelmäßig Leukoplasten, die ständig dem Licht ausgesetzt sind, ohne daß es zu einer Umwandlung in Chloroplasten kommt. Leukoplasten kommen auch in farblosen Blättern oder Blatteilen (=panaschierten Blättern) vor. Es gibt eine Reihe von Beispielen, die zeigen, daß sie durch Mutation aus Chloroplasten hervorgegangen sind, welche die Fähigkeit zur Chlorophyllbildung eingebüßt haben. Es gibt sogar einige Arten, wie z.B. die Nestwurz (Neottia, eine Orchidee), die überhaupt kein Chlorophyll mehr bilden können, deshalb auch keine Photosynthese treiben können und auf parasitische oder saprophytische Lebensweise angewiesen sind. (Saprophie: Abhängigkeit vom Vorhandensein toten organischen Materials.)
Eine zweite Klasse der Leukoplasten kommt regelmäßig in nichtgrünen Geweben ansonsten grüner Pflanzen vor. Besonders deutlich treten sie in der Wurzel in Erscheinung. Diese Leukoplasten können ergrünen, doch unterbleibt das normalerweise, weil Licht als Auslöser fehlt. Die Leukoplasten der Wurzelhaube (Calyptra) sind stärkehaltig und werden deshalb den Amyloplasten (stärkehaltigen Leukoplasten) zugerechnet. Wie an anderer Stelle dargelegt, kommt ihnen eine Funktion von Statolithen zu (Statholitenstärke), die eine entscheidende Rolle zur Wahrnehmung der Erdschwerkraft spielen (Geotropismus).
Stärke haben wir im vorangegangenen Abschnitt als Inhaltsstoff
von Chloroplasten und Leukoplasten (Amyloplasten) kennengelernt. Sie entsteht
durch Polymerisation von Glucoseresten, die ihrerseits als Produkte der
Photosynthese entstehen. Da Zucker in der Pflanze transportiert
werden können, z.B. aus Blättern in die Wurzel oder aus Blättern
in Samen und Früchte, erfolgt eine Stärkebildung auch in diesen
Speicherorganen. Je nach Pflanzenart werden in den Plastiden Stärkekörner
unterschiedlicher Form gebildet. Da man aus ihrer Gestalt auf die Herkunft
schließen kann, eignen sie sich zur Identifikation von Samen und
anderen stäkehaltigen Pflanzenteilen. Die folgenden Werte veranschaulichen
die Größenvariation ihrer Durchmesser: Stärke aus Kartoffelknollen:
70-100 µm aus Weizenendosperm: 30-45
µm und aus Maisendosperm 12-18 µm. Ihre Form spiegelt die Art der
Bildung wider. Die Stärkemoleküle
sind langgestreckt und wenig verzweigt. In den Plastiden werden sie - von
einem sogenannten Bildungszentrum ausgehend - radiär abgelagert. Dabei
wird Schicht auf Schicht angelegt, wobei die Schichtdicke von der durchschnittlichen
Moleküllänge abhängt. Ein Stärkekorn ist folglich kristallähnlich
(semikristallin) konstruiert, was man mit einem Polarisationsmikroskop
auch eindrucksvoll belegen kann. In angefeuchteten Präparaten ist
eine auf unterschiedlichem Hydratationsgrad (Wassergehalt) der einzelnen
Molekülabschnitte beruhende Schichtung erkennbar.
A. Modell für den Aufbau eines Stärkekorns. Die einzelnen Striche symbolisieren Stärkemoleküle. Aufgrund ihrer Anordnung entsteht ein radiales Muster. B. Schichtung der Stärkekörner. a. Bildungskern und Schichtungsgrenzen, b. Diagramm der Lichtbrechungsverhältnisse. Auf der Ordinate ist der Brechungsindex angegeben (Nach A. FREY-WYSSLING, 1938).
Je dichter die Molekülpackung ist, desto weniger Wasser wird eingelagert. Wasserarme Schichten wiederum sind stärker lichtbrechend als wasserreiche. Nach dem Austrocknen der Präparate verschwindet die Schichtung. Je nachdem, ob das Bildungszentrum zentral oder peripher gelegen ist, entstehen Stärkekörner mit konzentrischer oder mit exzentrischer Schichtung. Die Stärkekörner der Gramineen (Gräser: Weizen, Mais usw.) sind in der Regel konzentrisch, die der Kartoffel stets exzentrisch. Gelegentlich finden sich bei den genannten Arten in einem Plastid zwei bis drei Bildungszentren, was zur Anlage mehrerer Stärkekörner führt. Im Verlauf der Größenzunahme kann es dazu kommen, daß solche Zwillings- oder Drillingskörner schließlich von gemeinsamen Schichten umhüllt werden (halbzusammengesetzte Stärkekörner).
Zusammengesetzte Stärkekörner sind für die Haferstärke charakteristisch, sie bestehen aus einer großen Zahl von Teilkörnern.
Noch zwei weitere Beispiele: Stärkekörner in den Samen der Bohne (Phaseolus vulgaris) sind sehr groß, ihre Form ist rund oder oval, die Abstände der Schichten (Lamellen) voneinander sind sehr gleichmäßig. Das Zentrum ist durch Zugabe von Wasser leicht aushöhlbar. Im mikroskopischen Bild erscheinen daher - vom Zentrum ausgehend - radiale Risse. Im Milchsaft von Euphorbien (Wolfsmilchgewächsen, wie z.B. Euphorbia splendens) findet man hantelförmige Stärkekörner.

Viele Pflanzenzellen enthalten kristalline Einschlüsse unterschiedlicher chemischer Zusammensetzung und Form. Kristallaggregate werden Drusen, Bündel nadelförmiger Kristalle Raphiden genannt. Rasterelektronenmikroskopische Aufnahmen: a Calciumoxalat-Druse in einer Mesophyllzelle eines Blattes vom Oleander (Nerium oleander). Typische Drusenform der Dikotyledonen. b Calciumoxalat-Nadeln (Raphiden) aus der Wurzel von Vanilla (Orchidaceae). Typische Raphiden-Bündel der Monokotyledonen. e Herauspräparierte Kieselsäure-Körper aus den Kieselzellen der Epiderrnis von Schizachyrium sanguineum [einer Gramineen (Gras-) Art der Altwelttropen. Charakteristische Mineralisation einer Gramineenzelle. [W. BARTHLOTT, MARTENS, 1979 (c) W. BARTHLOTT, unveröff. (a, b)]
Von ganz wenigen Ausnahmen abgesehen, sind Pflanzenzellen von einer cellulosehaltigen Zellwand umgeben. Während des Wachstums ist sie plastisch, d.h. dehnungsfähig und verformbar. Nach Abschluß dieser Phase nimmt sie elastische Eigenschaften an, d.h., die Dehnbarkeit bleibt (in Grenzen) erhalten, doch die Verformbarkeit geht verloren. Aufgrund dieser veränderten Eigenschaften wird zwischen Primär- und Sekundärwand unterschieden. Wie wir bei der Besprechung elektronenmikroskopischer Aufnahmen der Wand sehen werden, unterscheiden sich die beiden Formen in erster Linie durch unterschiedliche Anordnung von Cellulosefibrillen. In der Primärwand liegen sie ungeordnet vor (Streutextur), in der Sekundärwand gerichtet und in Schichten übereinander gelagert (Ringtextur, Schraubentextur). Sekundärwände vieler Zellen (vor allem die der Festigungs- und Leitgewebe) sind durch zusätzliche wandverstärkende Substanzen inkrustiert. Einzelheiten zu ihrer Chemie in einem anderen Abschnitt, hier seien nur die Stichworte
Lignin (Grundsubstanz des Holzes) und
Suberin (Grundsubstanz des Korks) genannt.
Hinzu kommt, daß derart veränderte Sekundärwände oft phenolische Oxydationsprodukte enthalten, die ihnen eine dunkle Färbung (rötlich-schwarz mit verschiedenen Zwischentönen) verleihen.
|