
Beteiligung eines Carrierproteins am aktiven Transport bestimmter Moleküle durch die Membran. Der Transportvorgang ist spezifisch und energieaufwendig. Während des Transports macht das Protein eine Konformationsänderung durch (ping-pong Mechanismus).
Aktiver Transport beruht auf einem Zusammenwirken der molekularen Mechanismen eines carriervermittelten Transports (erleichterte Diffusion) und einer energieabhängigen Reaction, welche die zu transportierenden Partikel gegen ihr elektrochemisches Potential bewegen kann. Durch aktiven Transport können selbst große Moleküle durch eine Membran hindurchgeschleust werden. Um die Mechanismen im Detail zu verstehen, muß man sich einmal mit der Struktur der beteiligten Carriermoleküle befassen, zum anderen aber auch mit den Problemen der Energetik, vor allem mit der Frage, woher die Energie für den Transmembrantransport stammt und in welcher Form sie genutzt wird. In diesem Zusammenhang werden wir auf das bereits besprochene elektrische Gefälle zwischen Innen und Außen zurückkommen.
Aktiver Transport kann nur an in sich geschlossenen intakten Membranen erfolgen. Derartige Membranen können die verschiedensten Kompartimente umschließen, so z.B. die ganze Zelle, Vesikel, die Vakuole, die Matrix der Mitochondrien, den Thylakoidinnenraum der Chloroplasten usw. Durch aktiven Transport wird eine intrazelluläre Konzentrierung von Ionen und Metaboliten erreicht, und das Fließgleichgewicht des Stoffwechsels wird trotz großer Schwankungen in der Zusammensetzung des Außenmilieus weitgehend konstant gehalten. Ionen, insbesondere Kalium, Calcium, Magnesium und Phosphat- spielen eine wichtige Rolle in der Stoffwechselregulation.
Der aktive Transport trägt auch zur Erhaltung der osmotischen Verhältnisse zwischen Zellinhalt und seiner Umgebung bei. Die Transportrichtung wird über eine Kopplung an einen Gradienten - meist an einen Elektronengradienten - thermodynamisch bestimmt. Bei entsprechend gewählten Substratkonzentrationen kann die Richtung auch umgekehrt werden.
Als Folge der Atmungskette und der Photosynthese werden Protonen aus der Mitochondrienmatrix, respektive den Thylakoiden der Chloroplasten ausgeschleust. Dieser Protonenefflux ist zugleich mit einer Translokation elektrischer Ladung verbunden. Neben einem chemischen Gradienten von Protonen bildet sich demnach ein elektrisches Potential aus. Daher besteht eine starke Tendenz der Protonen (H+- Ionen) ins Kompartimentinnere zurückzukehren (protonentreibende Kraft; proton motive force). Diese, von P. MITCHELL (1966, 1974) gemachten Beobachtungen wiesen auf die Schlüsselstellung der Protonentranslokation hin. Die beim Rückstrom anfallende Energie wird zur ATP-Synthese verwandt; das dazu benötigte Enzym ist eine membrangebundene ATP-Synthetase. Je nachdem, ob die Reaktion in Mitochondrien oder Chloroplasten abläuft, spricht man von Atmungskettenphosphorylierung oder Photophosphorylierung.
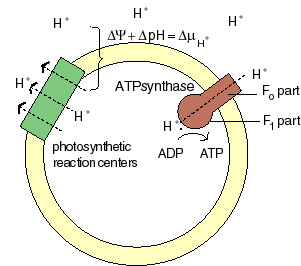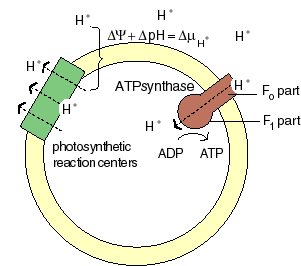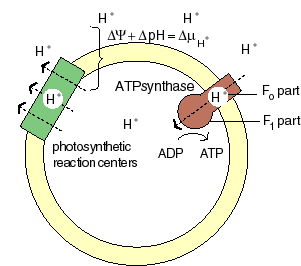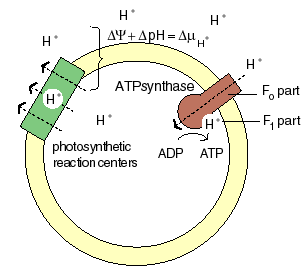
The chemiosmotic machinery of bacterial photosynthesis
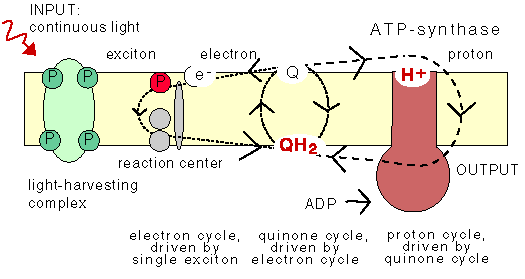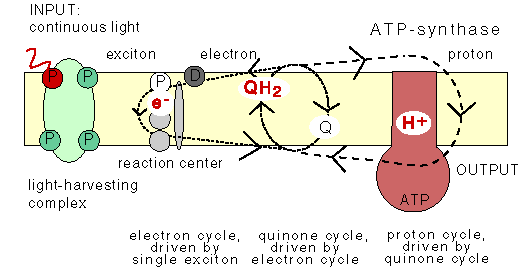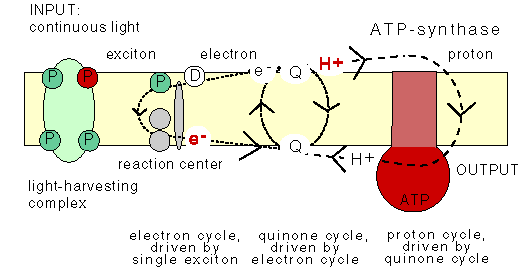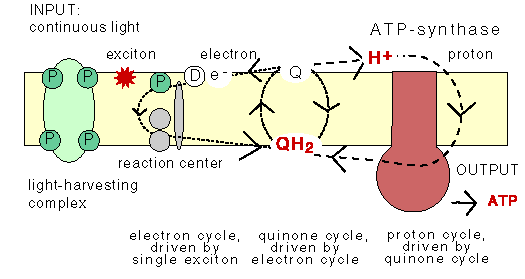
Bacteria, chloroplasts or mitochondria contain a closed membrane - they resemble a bag without holes. In chloroplasts and the photosynthetic bacteria this membrane contains photosynthetic reaction centers. Upon light absorption these reaction centers pump protons across the membrane, which becomes charged, and functions as a capacitor that stores electrical energy.
© 1999-2002 Anthonie W.J. Muller - The Thermosynthesis Home Page
Der Protonenrückfluß kann aber auch unter zwei weiteren Bedingungen erfolgen:
Durch einen Antiport, bei dem ein Proton durch ein anderes Kation ausgetauscht wird, das somit aktiv aus der Zelle - oder einem Kompartiment - ausgeschleust wird.
Durch einen Symport, d.h. einem Einschleusen des Protons in eine Zelle oder ein Kompartiment bei gleichzeitigem Einschleusen eines Anions oder eines Substratmoleküls. Hierdurch können Anionen oder (kleine) Moleküle von der Zelle aufgenommen und in ihr akkumuliert werden. Mit anderen Worten: ein elektochemischer Gradient wird als Energiequelle für den aktiven Transport von Molekülen und Ionen durch die Membran nutzbar gemacht. Neben dieser Energiequelle kann auch eine ATP-Spaltung für Transportvorgänge herangezogen werden.
Das entspricht einer Umkehr des vorhin geschilderten Prozesses. Die ATP-Synthetase arbeitet in anderer Richtung, Protonen (oder andere Kationen, z.B. Kalium) werden aktiv ausgeschleust (Protonenpumpe; Ionenpumpe, Transferase), und als Folge dieses Effekts bauen sich ein pH-Gradient und zugleich ein Membranpotential auf, die über einen Anti- oder Symport die Translokation anderer Moleküle (oder Ionen) nach sich ziehen. Wie eingangs vermerkt, haben wir es beim aktiven Transport mit zwei prinzipiell voneinander verschiedenen, jedoch gekoppelten Prozessen zu tun:
Carrierfunktion eines membrangebundenen Proteins. Die Transportrichtung hängt allein vom Substratgradienten ab und dient dem Ausgleich von Substratkonzentrationen.
Energieabhängiger Abschnitt, der zu einer Asymmetrie des Transports führt, so daß das transportierte Gut gegen ein (e,ektro-) chemisches Gefälle auf der einen Seite der Membran akkumuliert wird.
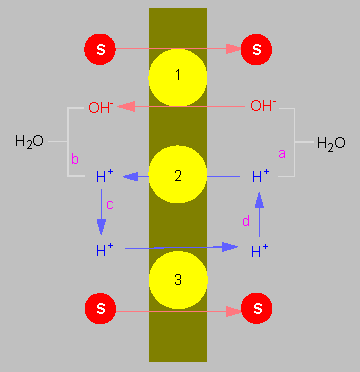
Chemiosmotische Kopplung des Transports von Molekülen durch eine Membran nach dem Prinzip des Antiports (oben) und des Symports (unten). Protonen und Transportgut werden in entgegengesetzte Richtungen, resp. in gleiche Richtung befördert. Die Energie wird durch den elektrochemischen Potentialgradienten, beruhend auf einem Protonenpumpmechanismus, bereitgestellt.
(Nach C. L. SLAYMAN und D. GRADMANN, 1975).
Die dadurch bewirkte asymmetrische Arbeitsweise des Carriers beruht auf einer energiefordernden Konformationsänderung des Moleküls (z.B. durch Phosphorylierung des Carriers). Die beiden Konformationszustände (phosphoryliert und nicht-phosphoryliert) zeichnen sich durch unterschiedliche Affinitäten zu ihren Substraten aus. Die Geschwindigkeitskonstanten der Permeation können dabei um Größenordnungen verschieden sein. Eine Reihe toxischer Substanzen, so z.B. Ammoniumionen oder Dinitrophenyl (DNP) gelten als Entkoppler. Sie zerstören den Protonengradienten, so daß nunmehr keine Energie für aktive Transportprozesse zur Verfügung steht.
Die für einen aktiven Transport benötigten membrangebundenen Proteine bestehen ausnahmslos aus oligomeren Komplexen, d.h. aus mehreren Proteinuntereinheiten. Man nennt sie oftmals auch Pumpen.
Eine reversible ATP-Synthetase (zur ATP-Spaltung befähigt), die ihre Energie aus der elektrischen Potentialdifferenz zwischen Innen und Außen bezieht, gehört zu den wichtigsten Komponenten des Gesamtkomplexes. Die Transportkinetiken der Pumpen sind - ähnlich denen bei der erleichterten Diffusion - mit Enzymkinetiken vergleichbar.
Die Proteinkomplexe arbeiten also ähnlich wie Enzyme, sie werden daher auch oft als Permeasen klassifiziert. Besonders ausgiebig wurden solche Proteine aus Membranen tierischer Zellen (z.B. der Erythrozyten) und auch aus denen der Mikroorganismen untersucht.
Oft weiß man, aus wie vielen (verschiedenen) Polypeptidketten ein Komplex zusammengesetzt ist, man kennt die Molekulargewichte, kennt die Reaktionskinetiken, d.h., man kann angeben, wie viele Ionen oder Moleküle pro Zeiteinheit befördert werden. Man weiß, daß viele Pumpen nur dann richtig arbeiten, wenn sie sich in der richtigen Umgebung befinden. Mit anderen Worten, wenn die Pumpen von den richtigen Phospholipiden umgeben sind. Es ist schließlich auch bekannt, daß sie stets in einer bestimmten (stets gleichen) Orientierung in der Membran integriert sind, denn der Transport erfolgt stets gerichtet.
Doch in keinem einzigen Fall kennt man die Tertiär- bzw. die Quartärstruktur des Komplexes, und nur die alleine würden es plausibel machen, warum gerade dieses und nicht ein anderes (ähnliches) Molekül (Ion) durch die Membran hindurchgelassen wird.
Die bekanntesten und am besten untersuchten Ionenpumpen sind die Natrium-Kalium-Pumpe und die Calcium-Pumpe. Die Natrium/Kalium-Pumpe wurde aus Membranen der unterschiedlichsten Zelltypen isoliert.
Es ist allgemein geläufig, daß Zellen präferentiell Kalium- und nur wenige Natrium- Ionen enthalten. Diese Aussage gilt auch für Pflanzen an salzhaltigen (Natrium-haltigen) Standorten (halophile Pflanzen). Gerade in Zellen jener Pflanzen wurde eine besonders hohe Aktivität eines Natrium/Kalium- Austausches nachgewiesen. Die Zellen investieren demnach eine beträchtliche Energiemenge, um auch an extremen Standorten eine möglichst niedrige Natrium- Konzentration im Cytosol aufrechtzuerhalten. Ein Teil des Natriums wird in die Vakuole gepumpt, wo es einerseits nicht stört, andererseits aber zur Aufrechterhaltung des osmotischen Drucks beiträgt. Eine Anzahl pflanzlicher Sekundärstoffwechselprodukte, z.B. die Glykoside Oubain (Strophanthin) und Digitonin inhibieren gezielt die Natrium/Kalium-Pumpe.
Nicht minder wichtig ist die Calcium-Pumpe, die vor allem auch an intrazellulären Membranen und Membranen der Organellen zur Wirkung kommt. Die Calcium-Konzentrationen in den einzelnen Kompartimenten unterscheiden sich um Größenordnungen. Andererseits ist Calcium dafür bekannt, in die Regulation von Stoffwechselwegen einzugreifen. Die Calcium-Pumpe hat demnach einen direkten Einfluß auf Durchsatzraten in vielen Biosynthesewegen.
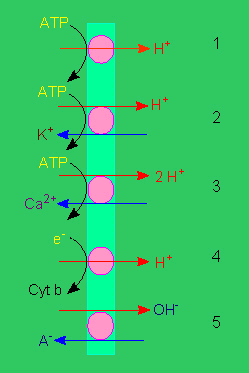
Protonenpumpen: 1. elektrogene Pumpe, 2. elektroneutrale Pumpe, 3. wie 2., jedoch mit Calcium als Gegenion, 4. elektrogener Protonentransport, 5. elektroneutraler Anion / OH - Antiport (Nach R. E. CLELAND, 1982).
Unser Wissen über die genaue Verteilung von Ionen in den einzelnen Kompartimenten ist noch sehr lückenhaft. Das gilt für pflanzliche Zellen noch weit mehr als für tierische.
Ein großer Vorteil der Mikroorganismen liegt u.a. darin, daß man Mutanten mit Defekten im Transportsystem isolieren und den Defekten den Ausfall oder die Veränderung ganz bestimmter Untereinheiten des Proteinkomplexes zuschreiben konnte. Man hat (in Mikroorganismen) zwei prinzipiell voneinander verschiedene Zuckertransportmechanismen nachweisen können:
Aktiver Zuckertransport via indirekter Kopplung an einen Energiespender. Das Substrat wird dabei unverändert durch die Membran geschleust. Das Trägermolekül (Carrier) ändert seine Affinität zum Substrat während dessen Translokation durch die Membran. An der Membranaußenseite ist sie hoch, innen niedrig. In vielen Zelltypen ist der Metabolit-(Substrat-) Transport an eine funktionsfähige Natrium/Kalium-Pumpe gekoppelt.
Aktiver Zuckertransport durch Modifikation des Substrats. Das Substrat wird während des Transports chemisch modifiziert. Beispiele hierfür sind die Phosphorylierung von Zuckern und die Glykosylierung von Adenin. Man bezeichnet diesen Vorgang als vektorielle Phosphorylierung. Der Transport wird also durch eine chemische Reaktion initiiert, wobei das Substrat in die Zelle "hineinphosphoryliert" wird.
|
|