In Pflanzenzellen kommen eine Anzahl unterschiedlicher Membrantypen vor:
![]() Plasmalemma (Plasmamembran)
Plasmalemma (Plasmamembran)
![]() Tonoplast
Tonoplast
![]() Kernmembran
Kernmembran
![]() Membranen des Endoplasmatischen Retikulums
Membranen des Endoplasmatischen Retikulums
![]() Membranen des Golgi-Apparats (Dictyosomen)
Membranen des Golgi-Apparats (Dictyosomen)
![]() Membranen der Chloroplasten
Membranen der Chloroplasten
![]() Membranen der Mitochondrien
Membranen der Mitochondrien
![]() Membranen der Peroxysomen, Glyoxysomen und weiterer Vesikel.
Membranen der Peroxysomen, Glyoxysomen und weiterer Vesikel.
Zur Trennung der einzelnen Kompartimente und Membrantypen bedient man sich heutzutage vor allem der Dichtegradientenzentrifugation. Hinzu kommt der Einsatz spezifischer Marker (z.B. Antikörper), mit deren Hilfe man entscheiden kann, ob ein bestimmter Molekülanteil (Antigen) an der Außenseite oder der Innenseite der Membran lokalisiert ist. Durch Kopplung fluoreszierender oder elektronendichter Marker läßt sich die Bindung der Antikörper fluoreszenzmikroskopisch oder elektronenmikroskopisch abbilden, und laterale Verschiebungen der Antigene in der Membranebene lassen sich verfolgen. Neben den Antikörpern spielen Lektine als Sonden zum Nachweis exponierter Zucker in Glykokonjugaten eine herausragende Rolle. Es sind kohlenhydratbindende Proteine meist pflanzlicher Herkunft, mit der Eigenschaft, ganz bestimmte Zuckerreste zu erkennen.
Die meisten Erkenntnisse über die strukturellen Unterschiede zwischen verschiedenen Membrantypen wurden an Membranen aus tierischen Zellen gewonnen. Erst in den letzten Jahren setzte in zunehmendem Maße eine Erforschung der Verhältnisse bei pflanzlichen Zellen ein. Einer der Gründe für die Verzögerung lag einmal darin, daß die Erforschung tierischer (vor allem auch menschlicher) Zellen im Rahmen medizinischer Forschung, speziell der Krebsforschung, mit gewaltigen Geldmitteln gefördert wurde, zum anderen aber auch darin, daß sich die pflanzliche Zellwand bei nahezu allen biochemischen und molekularbiologischen Untersuchungen als störend erwiesen hat. Erst nachdem es gelang, Protoplasten herzustellen, stand ein System zur Verfügung, um auch pfianzliche Membranen detailliert untersuchen zu können. Zwischen den einzelnen Kompartimenten einer Zelle findet ein Informations-, Material- und Energieaustausch statt.
Das Plasmalemma umschließt das Plasma einer jeden Zelle, es bildet die Grenzschicht zur extrazellulären Umgebung. Die Membran ist relativ dick (bis zu 100 Å). Neben den Lipiden enthält sie einen hohen Proteinanteil sowie einen hohen Anteil an Oligosacchariden, die meist an Proteine, aber auch an Lipide gekoppelt sind. Der überwiegende Teil, wenn nicht sogar alle Kohlenhydrate, ist an der Membranaußenseite exponiert, was schon allein auf einen asymmetrischen Bau der Membran hinweist. Elektronenmikroskopisch (in Aufsicht) erscheinen Außen- und Innenseite nach Gefrierätzung als hochgradig granulär. Jede Erhebung aus der Membranebene entspricht einem Proteinmolekülkomplex. In der Membran von Chlorella wurden Partikel von 80 Å Durchmesser nachgewiesen, die statistisch über die Membran verteilt sind. Es gibt Anhaltspunkte dafür, daß sie für die Synthese der Cellulosemikrofibrillen der Zellwand benötigt werden. Oftmals ist der Membran außen eine strukturlos erscheinende Schicht aufgelagert, die mit der Membran zusammen einen Komplex bildet. Wasser und Gase können die Membran ungehindert passieren, für hydrophobe Substanzen ist sie weitgehend semipermeabel, d.h., sie können relativ leicht in sie eindringen und sie durchdringen. Für hydrophile ist sie, vom aktiven Transport abgesehen, weitgehend impermeabel.
Ein wichtiges Merkmal ausdifferenzierter parenchymatischer Pflanzenzellen ist die ausgedehnte, zentral gelegene Vakuole, die bei weitem den größten Teil des Zellvolumens einnimmt und für den Turgor verantwortlich ist. In vielen anderen Zelltypen, vor allem in meristematischen Geweben, kommen mehrere, meist kleine Vakuolen vor. Vakuolen sind von einem bestimmten Membrantyp, dem Tonoplasten, umgeben. Sowohl auf der Innen- als auch auf der Außenseite (konkave und konvexe Oberfläche) sind Partikel in der Größenordnung von 85 Å Durchmesser erkennbar. Vakuolen unterscheidet man aufgrund unterschiedlicher Größe, der Zahl pro Zelle und ihrer Inhaltsstoffe, dazu gehören - außer dem Wasser - anorganische Ionen, organische Säuren, Zucker, Aminosäuren, Lipide, Oligosaccharide, gummiähnliche Substanzen, Tannine, Anthocyane, Flavonoide u.a. Proteinhaltige Vesikel differenzieren sich in Samen vieler Gras- und Leguminosenarten zu charakteristisch geformten Strukturen, den Aleuronkörnern. Sphärosomen sind ölhaltige, von einer Lipidschicht umgebene Partikel. Da eine Lipidschicht - formal gesehen - nur eine Membranhälfte repräsentiert, darf man die Sphärosomen eigentlich gar nicht zu den Vesikeln rechnen.
Im allgemeinen geht man davon aus, daß Vakuolen vorübergehende Speicher von Reservestoffen oder Endlager von Abfallprodukten der Pflanzenzelle sind. Doch nutzlos sind die dort gelagerten Substanzen keineswegs. Einerseits halten sie einen hohen osmotischen Druck der Zelle aufrecht, zum anderen stellen sie einen Stickstoffspeicher dar, zu dem die Pflanzenzelle jederzeit Zugang hat. Die Speicherung von Farbstoffen (z.B. in den Petalen der Blüten) bestimmt die Blütenfarbe und dient als Erkennungssignal für Insekten.
Bei einigen Arten, z.B. Hevea brasiliensis oder bei den Papaveraceen, kommen in milchsaftführenden Zellen statt einer großen, zahlreiche kleine Vakuolen vor. Vakuolen enthalten meist eine Anzahl abbauender Enzyme (Hydrolasen: Proteasen, Exopeptidasen, Nukleasen und andere Esterasen). Damit kann ihnen, zumindest bei einigen der daraufhin untersuchten Pflanzenarten, eine Lysosomenfunktion zugeschrieben werden; sie wirken an Umsätzen (turnover) zellulärer Proteine mit und bestimmen deren Rate. In den Vakuolen ist der pH-Wert in der Regel sehr niedrig, in Zellen der Zitrone (Frucht) beträgt er z.B. nur 2,5. Das beruht im wesentlichen auf dem hohen Anteil organischer Säuren, die ihrerseits Intermediärprodukte des Citratzyklus sind und vorübergehend (?) aus dem Stoffwechsel abgezogen werden, denn bei deren hoher Produktionsrate, bedingt durch Abbau von Kohlenhydraten zum Zweck des Energiegewinns, würde ohne Absonderung in die Vakuole der pH-Wert des Cytosols zu stark sinken. Die Folge wäre die Denaturierung (Inaktivierung) zahlreicher Enzyme. Einige der organischen Säuren in der Vakuole erreichen so hohe Konzentrationen, daß sie auskristallisieren, in Gegenwart geeigneter Kationen (z.B. Calcium) erfolgt die Kristallisation besonders effizient (z.B. Bildung von Calciumoxalat). Bei einigen Arten der Crassulaceen werden Anionen organischer Säuren, z. B. Malationen, nachts akkumuliert und dienen als Kohlendioxyd-Speicher. Tagsüber erfolgt eine Dekarboxylierung; Kohlendioxyd, wird abgegeben und via Photosynthese (CALVIN-Zyklus) wieder fixiert (CAM).
Eine weitere Stoffklasse, die in Vakuolen zum raschen Zugriff gespeichert wird, sind die Aminosäuren. Auch deren hohe Konzentration im Cytosol würde den pH-Wert stark absenken. Andererseits werden sie benötigt, sobald die Syntheserate bestimmter Enzyme, das Wachstum und die Vermehrung der Zellen aufgrund äußerer Faktoren sprunghaft ansteigen. Aleuronkörner enthalten als proteinreiche Vakuolen artspezifische Speicherstoffe, so z.B. das Vicelin in den Kotyledonen von Vicia faba.
In Sojabohnen kann der Anteil der Speicherproteine bis zu 70 Prozent des Gesamtzellproteins ausmachen. In Vakuolen, z.B. den Endospermzellen von Ricinus communis, liegen die Proteine in kristalliner Form vor.
Eine Frage zum Schluß: Wie gelangen Proteine aus dem Cytosol in die Vakuolen, wie passieren sie die Membran? Die Antwort darauf erfolgt im Abschnitt "Endoplasmatisches Retikulum".
Der Zellkern ist von einer aus zwei Membranen bestehenden Hülle umgeben. Man unterscheidet zwischen der inneren und der äußeren Membran. Im Bereich der Kernporen bilden diese ein Kontinuum. Darüber hinaus besteht ein fließender Übergang zwischen der äußeren ans Cytosol grenzenden Membran der Kernhülle und dem Endoplasmatischen Retikulum (ER). Sie trägt (wie das ER) stellenweise Ribosomen. Die Kernporen sind von einer Porenkomplex aus fibrillärem Material ausgefüllt, der seinerseits selektiv am Stoffaustausch zwischen Zellkern und Cytosol beteiligt ist. Die Zahl der Poren pro Flächeneinheit ist, zumindest bei einigen der daraufhin untersuchten Arten, von der Aktivität des Kerns abhängig, sie spiegelt die Rate des nukleo-cytoplasmatischen Austausches wider.
Im Kern ist genetische Information gespeichert. Er enthält den bei weitem größten Teil der DNS (des Genoms) der Zelle. In ihm findet die Replikation, die Transkription, das Processing der RNS und das Assembly (Zusammenlagerung von rRNS und Proteinen) der Ribosomen statt. Die benötigten Enzyme werden aus dem Cytosol in den Kern importiert. Der Import ist streng selektiv, die meisten der im Cytosol vorkommenden Proteine bleiben ausgeschlossen. An der Auswahl wirkt der Porenkomplex mit. Aus dem Kern ausgeschleust werden vornehmlich RNS und Ribosomen.

Das Endoplasmatische Retikulum (ER) ist ein umfangreiches intrazelluläres Membransystem, das in direktem Kontakt zur Kernhülle steht. Die dem Cytosol zugewandte Seite der Membran trägt häufig Ribosomen (rauhes ER). An Membranen gebundene Ribosomen sind befähigt, Polypeptidketten für den Export oder zur Speicherung zu synthetisieren. Induziert durch die Bindung des Ribosoms an die Membran, öffnet sich temporär eine Membranpore, durch die eine sich bildende noch ungefaltete Polypeptidkette durch die Membran hindurch synthetisiert wird. Die Tertiärstruktur bildet sich erst nach dem Eintritt in die ER- Zisterne. Voraussetzung für das Einschleusen in die Zisterne ist jedoch das Vorhandensein einer Signalsequenz am N-terminalen Ende. Man kennt Proteine, bei denen sie anschließend (in der Zisterne) durch spezifische Peptidasen abgebaut wird; es gibt aber auch exportierte Proteine, bei denen sie erhalten bleibt und einen integralen Bestandteil ihrer Struktur ausmacht.
Proteine werden durch die Membran "hindurchsynthetisiert". Das Modell veranschaulicht, wie Proteine während der Synthese durch die Membran hindurchgeschleust werden. Die Membranporen öffnen sich nur nach Bindung eines Ribosoms. Das N-terminale Ende der wachsenden Polypeptidkette trägt eine Signal- oder Transitsequenz und tritt daher stets als erstes durch die Membran hindurch. Nach dem Durchtritt wird die Signalsequenz (in der Regel) durch Proteasen abgebaut. Es gibt für die unterschiedlichen Membrantypen unterschiedliche Transitsequenzen. (Nach G. BLOBEL und B. DOBBERSTEIN, 1975).
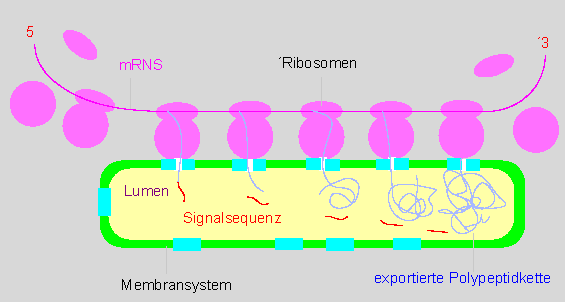
Die Signalsequenz ist membrantypspezifisch. Proteine, die durch unterschiedliche Membrantypen durchgeschleust werden, verfügen über ein Sortiment unterschiedlicher Signalsequenzen. Neben dem rauhen ER findet man in den Zellen oft auch das glatte ER, an dem keine Proteine synthetisiert werden, das in der Zelle andere Aufgaben wahrnimmt, u.a. an der Synthese bestimmter lipophiler Substanzen beteiligt ist. Das Endoplasmatische Retikulum ist vom Golgi-Apparat (s. folgenden Abschnitt) zu unterscheiden. Beide zusammen bilden das Endomembransystem.
Der Golgi-Apparat ist die Summe aller Dictyosomen und der Golgi-Vesikel einer Zelle. Die Dictyosomen sind in charakteristischer Weise gestapelte Zisternen, die an den Rändern oft verzweigt oder gelappt sind, Tubuli (röhrenförmige Auswüchse) und peripher bläschenförmige Abkömmlinge tragen, die Golgi-Vesikel abschnüren. Die Dictyosomen pflanzlicher Zellen sind an der Zellwandsynthese, an Sekretionsprozessen von Makromolekülen und am Membranfluß beteiligt. Unter Membranfluß im engeren Sinne versteht man den Transfer einer Membran von einem Kompartiment des intrazellulären Membransystems zu einem anderen. Da man einen Membranfluß in der Zelle in der Regel nicht direkt verfolgen kann, ist man auf die Auswertung von Serien elektronenmikroskopischer Aufnahmen angewiesen. Sie stellen Momentaufnahmen der Situation in der Zelle dar. Zur Rekonstruktion eines Membranflusses müssen umfangreiche Bildserien von Zellen, in denen der Membranfluß durch geeignete Inhibitoren blockiert ist, im Vergleich mit unbehandelten Kontrollen ausgewertet werden. Solche Analysen sind in großem Stil an einer Reihe tierischer Zellen durchgeführt worden. Sie führten zu dem Schluß, daß Golgi-Membranen aus dem (rauhen) Endoplasmatischen Retikulum entstehen können. Die Daten aus pflanzlichen Zellen sind bislang lückenhaft, doch zeichnet sich schon jetzt ab, daß es zumindest quantitative Unterschiede in den Raten des Vesikeltransports zwischen dem Endoplasmatischen Retikulum und den Dictyosomen gibt. Darüber hinaus gibt es quantitative Unterschiede in Zelltypen verschiedener Herkunft.
In elektronenmikroskopischen Aufnahmen von Zellen höherer Pflanzen erkennt man, daß der Golgi-Apparat, im Gegensatz zur Situation in tierischen Zellen, räumlich weniger eng mit dem Endoplasmatischen Retikulum assoziiert ist. Tierische Zellen sezernieren viel Protein, pflanzliche Zellen hingegen vorwiegend Kohlenhydrate. Doch auch diese Aussage ist mit Vorsicht zu behandeln, denn sie ist mehr von quantitativem als qualitativem Wert.
Bei einem Membrantransport und der Umwandlung eines Membrantyps in einen anderen sind mindestens drei Schritte zu betrachten:
- Die laterale Bewegung (Bewegung in der Membranebene) von Lipid- und Proteinmolekülen. Bildlich gesprochen könnte man sagen, daß bestimmte Moleküle in der Membranebene selektiv beiseite geschoben werden.
- Die Fusion zweier Membranen und, sich daraus ableitend,
- die Abschnürung membranumgebener Vesikel.
Abschnürung und Fusion sowie Veränderungen auf molekularer Ebene (Membrantransformation) erklären das Zustandekommen anderer Membransysteme. Golgi-Vesikel können mit der Plasmamembran fusionieren und dabei ihren Inhalt in das umgebende Medium entleeren (Exocytose). Ebenso gibt es eine Prozeßumkehr (recycling von Membranen): Das Plasmalemma stülpt sich lokal ins Zellinnere hinein und schnürt Vesikel ab (Endocytose). Hierdurch gelangen extrazelluläre Substanzen ins Zellinnere, und je nachdem, ob sie flüssig oder fest sind, spricht man von Pinozytose oder Phagozytose.
Zum Verständnis des Exports von Makromolekülen (Proteinen und Poly-/Oligosacchariden) sind folgende Befunde entscheidend:
Der Eintritt von Polypeptiden (und damit auch von Enzymen) in die ER - Zisterne erfolgt während der Synthese an Ribosomen des Endoplasmatischen Retikulums. Sie gelangen damit in dessen Lumen. Polysaccharide (Oligosaccharide) entstehen durch enzymatischen Aufbau aus UDP-Monosacchariden. Pumpmechanismen (aktiver Transport ) erklären, wie die Monomeren ins Lumen des ER oder in die Golgi-Zisternen gelangen. Durch die dort lokalisierten Glucosyl-Transferasen werden sie zu Polymeren verknüpft, oder es entstehen Oligosaccharide, die an Proteine oder Lipide gekoppelt werden (Glykokonjugate).
Durch Abschnürung von Vesikeln des Endomembransystems via Golgi-Apparat werden Makromoleküle aus der Zelle ausgeschleust (s.o.).
Wenngleich auch hier wieder die meisten Aussagen durch Ergebnisse an tierischen Zellen gesichert wurden, ist es wahrscheinlich, daß die Prozesse in der Pflanzenzelle auf gleiche oder doch zumindest ähnliche Weise erfolgen, wobei natürlich auch hier wieder prinzipiell unterschiedliche Synthese- und Umschlagraten in Betracht zu ziehen sind.
Ein Teil der durch die Membran hindurch synthetisierten Proteine (Enzyme) bleibt in der Membran verankert. Das bedeutet, daß enzymatische Umsetzungen auch noch in den Golgi-Vesikeln und, nach ihrer Fusion mit dem Plasmalemma, an dessen Außenseite erfolgen können. Das ist sehr wichtig, denn dieser Prozeß veranschaulicht, wie die Pflanzenzelle extrazellulär komplexe Polysaccharidsynthesen bewerkstelligen kann, so wie sie bei der Zellwandbildung und der Produktion von Gallerten (Schleimen) benötigt werden.
Neben der Synthese von Polysacchariden sowie der Veränderung und der Sortierung von Glykoproteinen in den Dictyosomen fällt ihnen die Aufgabe des intrazellulären Transports zu. Er erfolgt gerichtet und aktiv und ist damit energieverbrauchend. Sowohl Mikrotubuli als auch Mikrofilamente scheinen dabei mitzuwirken.
Für die Fusion der Golgi-Vesikel mit der Plasmamembran werden Calciumionen benötigt. Nach Abfangen dieser Anionen durch einen geeigneten Komplexbildner unterbleibt die Fusion.
Die Membranstapel des Golgi-Apparats (Dictyosomen) weisen eine deutliche Polarität auf, die durch eine Reihe von Parametern gemessen werden kann. Etliches weist darauf hin, daß es einen Fluß von Zisternen durch den Golgi-Apparat gibt, so daß man von einem Reifungsprozeß der Membranen und Vesikelinhalte sprechen kann.
|
|