Peptide - vor allem die Polypeptide (=Proteine) - spielen in jeder Zelle eine herausragende Rolle. Sie erfüllen die Funktion biologischer Katalysatoren (=Enzyme), sind an der Regulation des Zellstoffwechsels und der Interaktion zwischen Zellen beteiligt und werden für den Aufbau spezifischer Strukturen benötigt. Es sind primär lineare Kettenmoleküle, die aus einer Aufeinanderfolge von Aminosäuren bestehen, wobei die Verknüpfungen ausschließlich über Peptidbindungen erfolgen.
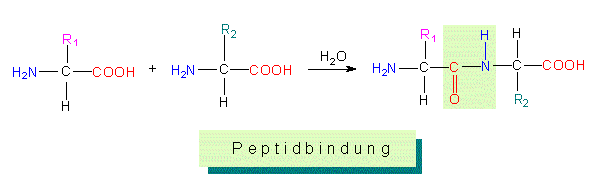
Dieser Bindungstyp bedingt eine Polarität im Molekül; denn unabhängig von der Kettenlänge bleibt an einem der Enden eine freie Aminogruppe, am anderen eine freie Karboxylgruppe übrig (= N-terminales und C-terminales Ende). Aminosäuresequenzen werden vom N- zum C-terminalen Ende geschrieben, diese Richtung entspricht auch der Syntheserichtung. Die genaue Abfolge der Aminosäuren (Aminosäuresequenz, Primärstruktur des Proteins), determiniert durch die Sequenz von Nukleotiden in Nukleinsäuren (=Kolinearität), charakterisiert ein bestimmtes, spezifisch wirkendes Proteinmolekül.
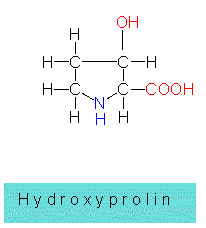
Seine Synthese ist ein aufwendiger, komplexer Vorgang (Proteinbiosynthese), in dessen Verlauf die in den Nukleinsäuren gespeicherte genetische Information in die Aminosäuresequenz eines Proteins übersetzt (translatiert) wird. Bei kurzen Peptiden kann der Synthesemodus anders sein. In vielen Fällen werden die Aminosäuren enzymatisch zu kurzen Ketten verknüpft. Hierbei können auch die sogenannten seltenen Aminosäuren, das sind solche, die nicht dem Standardrepertoire der 20 angehören, verwertet werden. Es gibt aber auch Fälle, bei denen aus einer bestimmten normal in ein Protein eingebauten Aminosäure durch nachträgliche enzymatische Veränderung eine modifizierte entsteht. Ein Beispiel hierfür ist die Umwandlung von Prolin zu Hydroxyprolin.
Zur vorläufigen Charakterisierung eines gegebenen Proteins muß man wissen
| wie viele Aminosäuren die Polypeptidkette enthält (Die Zahlen liegen normalerweise in der Größenordnung von 100), | |
| um welche es sich dabei handelt, und in welcher Reihenfolge sie angeordnet sind. |
Die Primärstruktur zahlreicher Proteine ist bekannt, als Beispiel sei hier die Primärstruktur des Hüllproteins des Tabakmosaikvirus und des Cytochroms c aus Hefe genannt. Die analysierten Primärstrukturen (über 70 000 Anfang März 1998) können von Datenbanken abgerufen werden. Die Seqenzen der Proteinprimärstrukturen werden im Rahmen des Projekts SWISSPROT in der Schweiz gesammelt.
Die Daten können z. B. auch von den Datenbanken des Europäischen Laboratoriums in Heidelberg oder das European Bioinformatics Institute in Hinxton/England bezogen werden. Die Datenbanken bieten eine Fülle von Such- und Vergleichsmöglichkeiten der ausgewählten Sequenzen:
So wichtig diese Daten auch sein mögen, ist mit ihnen allein wenig anzufangen; denn um die Funktion eines Proteinmoleküls zu verstehen, muß man wissen, wie sich die Polypeptidkette räumlich faltet. Die chemische Reaktivität der Seitenkettenreste bedingt eine genau vorgegebene spezifische dreidimensionale Struktur, die Tertiärstruktur. Während die Bildung der Primärstruktur ausschließlich auf der Ausbildung kovalenter Bindungen (Peptidbindungen) beruht, spielen diese bei der Ausbildung der Tertiärstruktur nur eine untergeordnete Rolle. Der einzige hierfür wichtige Bindungstyp ist die Disulfidbrücke, die zwischen den Seitenketten zweier Cysteinreste entstehen kann.
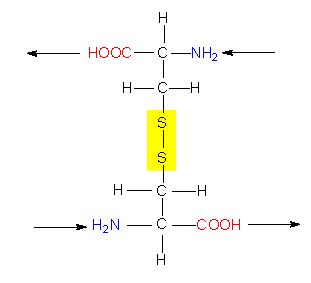
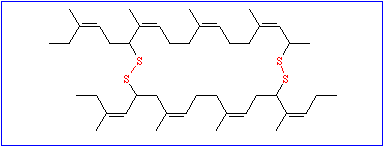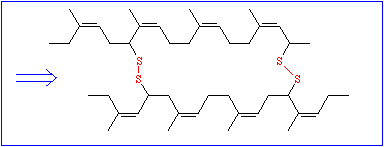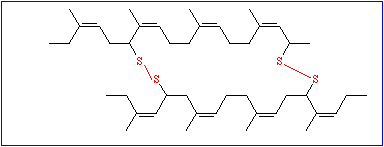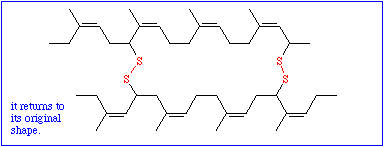
Alle übrigen gehören in die Kategorie der schwachen Wechselwirkungen und gehören folgenden Typen an:
|
| ionische Interaktionen | |
| Wasserstoffbrücken | ||
| van der Waals'sche Interaktionen. |
Durch Wasserstoffbrücken stabilisiert, können regelmäßige Faltungen (Sekundärstrukturen) der Polypeptidkette entstehen, dabei können
| die Wasserstoffbrücken zwischen nahe beieinander liegenden Aminosäureresten (in regelmäßigen Abständen) ausgebildet werden, so daß sich die Kette zu einer Schraube windet. Der bekannteste, stabilste und deshalb auch häufigste Schraubentyp ist die alpha-Helix. Stabil heißt jedoch nicht starr: wie in allen Molekülen sind die einzelnen Atome zueinander beweglich angeordnet. In Lehrbüchern angegebene Bindungslängen und -winkel sind immer nur über Zeit und Raum gemittelte Werte. |
| Wasserstoffbrücken können aber auch zwischen Polypeptidketten entstehen, welche parallel (oder antiparallel) ausgerichtet nebeneinander liegen. Auf diese Weise erhält man beta-Faltblattstrukturen |
Polypeptidkette. Faltungstyp: paralleles beta-Faltblatt. Das eigentliche Faltblatt entsteht erst dann, wenn mehr als zwei Polypeptidkettenanteile parallel zueinander angeordnet sind.
Antiparalleles beta-Faltblatt: Bei dieser Konfiguration lagern sich Polypeptidkettenanteile antiparallel zusammen.
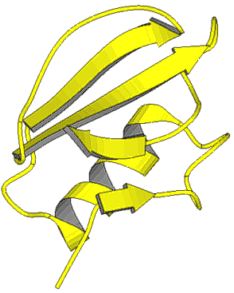
Ein weiteres eindrucksvolles Beispiel für ein Protein mit hohen Faltblattanteil ist das Concanavalin A
Sekundärstrukturen können in Proteinen vorkommen, doch ist ihre Existenz nicht zwingend. In vielen Proteinen sind nur kleine Anteile der Polypeptidkette in solche Strukturen verwickelt. Die Ausbildung einer Tertiärstruktur (Faltung der Polypeptidkette im dreidimensionalen Raum) erfolgt immer, doch sind die Art, wie sie gebildet wird, und die Form des fertigen Moleküls nicht ohne weiteres vorhersagbar.
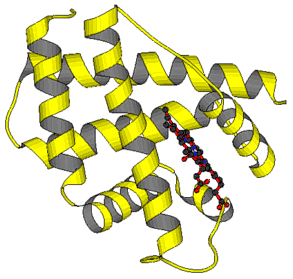
Beispiele für Tertiärstrukturen: Links: Leghämoglobin. Die Polypeptidkette faltet sich überwiegend zu alpha-Helices. Rechts: Chymotrypsin. Paralleles beta-Faltblatt (im oberen Teil des Bildes), antiparalleles beta-Faltblatt (im unteren Bildteil), alpha-Helix (im Hintergrund). Tertiärstrukturen können auf unterschiedliche Weise dargestellt werden. Zur Darstellung graphischer Modelle bedient man sich heutzutage der Daten aus entsprechenden Datenbanken und arbeitet sie mit verfügbaren Programmen um. Mehr hierzu im Essay: Graphische Darstellung von Proteinstrukturen. Weitere Beispiele. Bakterienchlorophyll, ConA, TMV (alternative Darstellungen: "Backbone", "Space-Fill"), WGA
ein interaktives Lernprogramm zur Demonstration von Chime-Eigenschaftenn
Es gibt auch nur eine Methode zur Aufklärung von Tertiärstrukturen, und das ist die Röntgenstrukturanalyse. Andererseits ist die Kenntnis der genauen Faltung einer Polypeptidkette gerade für Biologen von eminenter Wichtigkeit. Denn nur wenn wir sie kennen, können wir eine Erklärung für die Wirkungsweise des betreffenden Moleküls geben. Nur dann läßt sich überhaupt sagen, warum ein Enzymmolekül diese und keine andere Reaktion katalysiert, warum seine Affinität zu einem Substrat höher ist als zu einem anderen, und warum ein bestimmter Hemmstoff (Inhibitor) wirksam ist und ob seine Wirkung vom Verhältnis Substrat zu Inhibitor abhängt oder nicht (kompetitive und nicht-kompetitive Hemmung). Anders ausgedrückt: Durch die Ausbildung einer Tertiärstruktur wird eine lineare Information (hier: die Abfolge einer Aminosäuresequenz) in eine dreidimensionale Struktur transformiert. Zum Verständnis biologischer Prozesse - ganz allgemein, zum Verstehen von Leben - ist die Kenntnis von Strukturen und ihrem Aufbau unerläßlich. Nebenstehendes Bild: Röntgendiagramm eines Proteinkristalls (Myoglobin), J. D. KENDREW, Cambridge. Durch Auswerung des Diagramms erhält man die Elektronedichteverteilung im Molekül und und muß diese mit einem Molekülmodell zur Deckung bringen. |
 |
Viele Proteine werden im Anschluß an ihre Biosynthese modifiziert, die Rohform wird in einen aktiven Zustand überführt, dabei werden entweder
| Stücke von einem der Enden abgespalten, oder | |
| es werden einzelne Aminosäuren verändert, z.B. Prolin in Hydroxyprolin,oder sie werden acetyliert oder phosphoryliert, schließlich können | |
| weitere Faktoren (Kofaktoren, Koenzyme) über schwache Wechselwirkungen oder kovalente Bindungen an die Polypeptidkette (Apoenzym) angelagert werden. Die eigentliche enzymatische Reaktion erfolgt dabei meist nicht am Protein selbst, sondern am Koenzym: Koenzym + Apoenzym = Holoenzym. |
Zahlreiche funktionelle Proteine bestehen aus Aggregaten mehrerer Polypeptidketten (oligomere Proteine). Dabei kann es sich um gleichartige, aber auch um verschiedene Ketten (Untereinheiten, U.E.) handeln. Diese Organisationsform wird als Quartärstruktur bezeichnet.
Proteine, die solche Quartärstrukturen aufweisen, können entweder mehrere enzymatische Funktionen ausüben, oder, was weit häufiger ist, ihre enzymatische Aktivität kann durch das Substratangebot oder durch andere Metaboliten gesteuert werden. Die Ursache für diesen Mechanismus ist darin zu suchen, daß die Tertiärstruktur der einzelnen Ketten nicht absolut starr ist, sondern aufgrund ihrer Flexibilität verformt werden kann, so daß die Information über die Bindung eines Substrat- oder Regulatormoleküls an eine der Untereinheiten über direkten molekularen Kontakt an die übrigen weitergegeben werden kann und damit deren Reaktivität modifiziert (allosterische Proteine, Allosterie).
Obwohl beispielsweise in einer Bakterienzelle im Vergleich zu einer Pflanzen- oder Tierzelle nahezu die gleichen enzymatisch katalysierten Reaktionen ablaufen, sind die daran beteiligten - homologen - Enzyme einander zwar ähnlich, doch niemals gleich. Sie haben sich im Verlauf der organismischen Evolution ebenfalls verändert. Daher sind solche Unterschiede hilfreiche Marker bei der Rekonstruktion von Abstammungslinien.
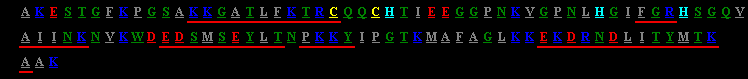
Die Aminosäuresequenz des Cytochroms c aus Hefe (112 Aminosäurereste). Zur Kennzeichnung der Aminosäuren wurde die Einbuchstabennomenklatur gewählt, zur Markierung der reaktiven Gruppen ein Farbcode: grau: hydrophobe Aminosäuren, grün: hydrophile Aminosäuren, rot: saure Aminosäuren (Asparaginsäue, Glutaminsäure), dunkelblau: Basische Aminosäuren (Arginin, Lysin), hellblau: Histidin, gelb: Cystein. Aminosäuren in rot unterstrichenen Sequenzabschnitten bilden alpha-Helices.
Die gezeigte Abbildung ist ein Screenshot aus dem Projekt STING (Sequence To and withIN Graphics. Es ist unter http://honiglab.cpmc.columbia.edu/STING/ erreichbar. Der überragende didaktische Vorteil dieses JAVA-Script Angebots liegt darin, daß Sequenzen und Tertiärstrukturen zugleich aus Datenbanken aufgerufen und miteinander verglichen werden.
STING is a WWW tool for the simultaneous display of information about macromolecular structure (in STING's Graphics Frame) and sequence (in STING's Sequence Frame). Special attention is given to MacroMolecular INTERFACE analysis. (entwickelt von: Goran Neshich's Lab. EMPBRAPA, Brasilien)
Die Aminosäurereste in der Sequenz können angeklickt werden, um sie in der Tertiärstruktur selektiv hervorzuheben. Es können auch ganze Helixabschnitte markiert werden, um deren räumliche Position anzuzeigen. Gleiches gilt für die Hervorhebung reaktiver Gruppen oder der Hydrathülle, um ein weiteres Beispiel zu nennen, sowie anderer molekularer Eigenschaften.
|
|