Eukaryotische Zellen sind im Vergleich zu prokaryotischen groß, das Oberflächen / Volumen-Verhältnis ist ungünstiger. Sie zeichnen sich darüber hinaus durch umfangreiche intrazelluläre Membransysteme aus; die äußere Membran (das Plasmalemma) ist sehr flexibel, sie kann sich äußeren Unebenheiten anpassen, kann Ausstülpungen ausbilden, und Vesikel können nach innen und nach außen abgegeben werden. Von wenigen Ausnahmen abgesehen, sind eukaryotische Zellen Aerobier. Es gibt zwingende Gründe für die Annahme, daß das nicht immer schon so gewesen ist und daß primitive eukaryotische Zellen anfangs anaerob lebten.
Der Größenzuwachs setzt im Vergleich zu den Prokaryoten eine Erhöhung des Stoffumsatzes voraus. Eukaryotische Zellen mußten sich in nahrungsreichen Biotopen entwickelt haben. Diese Annahme scheint gerechtfertigt, denn durch Photosyntheseaktivitäten der Blaualgen entstanden nicht nur große Mengen freien Sauerstoffs, sondern in stöchiometrischen Mengen auch fixierter Kohlenstoff, und damit eine Akkumulation von Biomasse in vorher nicht dagewesenem Ausmaß. Primitive eukaryotische Zellen haben vermutlich davon profitiert. Heterotrophe Zellen nutzten das Nahrungsangebot und gewannen an Größe.
Was unterscheidet sie noch von Prokaryoten?
Die Zellen der Eukaryoten enthalten bestimmte strukturbildende und für Bewegungen verantwortliche Molekülkomplexe: Aktin und Myosin und die dazugehörigen Regulatormoleküle einerseits, Tubulin andererseits (Cytoskelett).
Die genetische Information ist auf mehrere DNS-Moleküle (Chromosomenäquivalente) aufgeteilt und in einer durch eine Membran abgeschlossenen Einheit, dem Zellkern, gespeichert.
Unter Mitwirkung des Tubulins entwickelte sich ein Verteilungsmechanismus für Chromosomen (-äquivalente), die Mitose.
Mit der Fähigkeit, organisches Material aufzunehmen, gewannen große, zellwandlose (!) eukaryotische Zellen auch die Eigenschaft, kleinere Zellen aufzunehmen (Phagozytose) und zu verwerten.
Ein Spezialfall von (4.): Nutzung kleiner Zellen kann zu einer symbiotischen Lebensweise mit ihnen (Endosymbiose) führen. Nach der heute weitgehend akzeptierten Endosymbiontenhypothese haben primitive amöboide eukaryotische Zellen aerob lebende Bakterien (mit Atmungskette) als Symbionten aufgenommen. Die beiden Partner wurden zu einer Einheit, die die Fähigkeit erwarb, das mit der Zeit wieder knapper werdende Nahrungsangebot erheblich besser zu nutzen. Diese nunmehr aerob lebenden Eukaryoten behielten die heterotrophe Ernährungsweise bei.
Einige wenige dieser Zellen gingen eine Symbiose mit Blaualgen oder blaualgenähnlichen Prokaryoten ein und wurden so zu Vorläufern pflanzlicher Zellen, die sich durch photoautotrophe Ernährungsweise auszeichnen.
Eukaryotische Zellen erwarben die Fähigkeit zur Differenzierung und Arbeitsteilung und zum Aufbau vielzelliger Organismen.
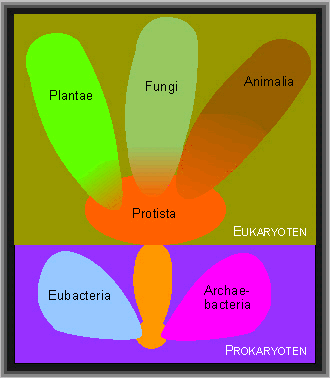
Sie lassen sich vier Reichen zuordnen:
- Protisten (meist einzellige Arten)
- Pflanzen (Plantae)
- Pilze (Fungi)
- Tiere (Animalia)
Den Prokaryoten gehören zwei Reiche (Eubakterien und Archaebakterien) sowie die Entwicklungslinie, die zu den Eukaryoten führte, an
(verändert nach R. H. WHITTAKER).
Es besteht kein Zweifel darüber, daß sich Pflanzen, Pilze und Tiere aus Vorstufen entwickelt haben, die den Protisten zuzurechnen sind. Wie sind die unter (1.) - (7.) genannten Leistungen zustande gekommen? Wie sah deren Evolution aus?
Zu 1: Aktin, Myosin und Tubulin kommen weder bei Eu- noch bei Archaebakterien vor. Die drei genannten Proteine können nicht auf einen gemeinsamen Vorfahr zurückgeführt werden, denn die Unterschiede zwischen ihnen sind weit größer als irgendwelche Gemeinsamkeiten.
© James A. Sullivan: http://www.cellsalive.com
Aktin ist eines der häufigsten Proteine tierischer Zellen sowie der Zellen vieler Protisten (z.B. der Amöben), Schleimpilze und Pflanzen. Es ist Bestandteil kontraktiler Elemente (Mikrofilamente). Es ist mit Sicherheit an amöboider Bewegung beteiligt, und damit kommt ihm vermutlich auch eine entscheidende Rolle bei der Phagozytose zu. Da auch jene Zellen (Amöben) auf ein externes Nahrungsangebot angewiesen waren, versetzte sie das Bewegungsvermögen in die Lage, auf Nahrungssuche zu gehen.
Tubulin ist ein Protein, das wie Aktin zu kontraktilen Elementen (den Mikrotubuli) aggregieren kann. Für zwei Bewegungsabläufe ist es unentbehrlich:
Bewegung von Chromosomen während der Mitose. Die Kernspindel besteht vornehmlich aus Mikrotubuli,
Geißel- und Cilienbewegung. Die Geißeln (und Cilien) aller eukaryotischen Zellen sind nach einem Einheitsschema ("9 + 2") organisiert. Es handelt sich (im Gegensatz zu Geißeln der Bakterien) um intrazelluläre Strukturen. Die Mikrotubulibündel sind, wie der übrige Zellinhalt, von einer ununterbrochenen Membran (Plasmalemma) umgeben. Geißelbewegung erfolgt nur bei Energiezufuhr (ATP).
Zu 2. Die Bildung eines von einer Doppelmembran (Hülle) umgebenen Zellkerns muß bereits sehr früh erfolgt sein, denn kernlose Eukaryotenzellen sind nicht bekannt. Die DNS fast aller Eukaryoten (Ausnahme z.B. Dinoflagellaten) ist stets mit basischen Proteinen (Histonen) assoziiert. Die Assoziation hat einen hohen adaptiven Wert, was darin zum Ausdruck kommt, daß sich vier von fünf Histonen (vor allem das Histon IV) während des Zeitraums der Diversifikation von Pflanzen und Tieren kaum verändert haben. Manche Ciliaten (z.B. Tetrahymena) enthalten ein Histon IV, das sich in 22 Prozent seiner Aminosäurereste von dem der Tiere und Pflanzen unterscheidet. Daraus kann der Schluß gezogen werden, daß die Wechselwirkung zwischen Histonen und DNS auf der Evolutionsstufe der Protisten noch nicht optimiert ist.
Zu 3. Die Existenz eines Zellkerns ist nicht mit der Existenz einer Mitose gleichzusetzen. Bei vielen Protisten (und Pilzen, z.B. Hefe) sind keine Chromosomen erkennbar. Während der Kern- und Zellteilung tritt ein unübersichtlich erscheinendes Gewirr an Fäden auf. Wegen des Vorkommens von Kopplungsgruppen scheint das genetische Material auf verschiedene strukturelle Einheiten aufgeteilt zu sein. Eine ähnliche Situation liegt bei einigen chloroplastenhaltigen Flagellaten (z.B. Euglena) vor.
Bei etlichen Dinoflagellaten kommen während der Kern- und Zellteilung innerhalb des Kerns mehrere Ansammlungen fibrillär aussehender Gebilde vor, die man vielleicht funktionell, nicht jedoch strukturell als Chromosomen bezeichnen könnte. Ein Spindelapparat wird nicht ausgebildet. Die Trennung genetischen Materials erfolgt innerhalb der Kernmembran. Bei anderen Dinoflagellaten wiederum findet man Ansätze zur Organisation eines Spindelapparats außerhalb des Zellkerns. Die Spindelfasern kommen jedoch nicht mit der DNS in Kontakt, da auch hier die Kernmembran zwischen den beiden Molekülaggregaten erhalten bleibt. Bei einer dritten Gruppe erkennt man im elektronenmikroskopischen Bild deutlich abgegrenzte Bereiche in der Membran, die als spezifische Adaptoren zwischen DNS und Mikrotubuli einzustufen sind. Vielleicht sind dies Vorstufen der späteren Spindelansatzstelle (dem Centromer), doch steht ein eindeutiger Homologiebeweis noch aus (D. F. KUBAI, 1975).
Für die Mitose gilt, was schon früher für andere wertvolle Strukturen gesagt wurde: Nachdem der Mechanismus sich erst einmal entwickelt und vervollkommnet hat, blieb er erhalten und wurde später nie abgeändert. Man kennt eine ganze Anzahl von Protisten, bei denen diese Entscheidung bereits gefallen ist. Auffallend ist, daß gerade Protisten eine große Zahl von Chromosomen (mehrere 100) besitzen, während sich die genetische Information von Vielzellern auf nur wenige Chromosomen (meist weit unter 50) konzentriert. Es ist offenbar einfacher, eine kleine Zahl von Einheiten gleichmäßig und fehlerfrei auf die Tochterzellen zu verteilen als sehr große Zahlen.
Zu 4-6. Die Endosymbiontenhypothese gewann in den letzten Jahren immer mehr an Wahrscheinlichkeit, denn je mehr man sich mit den Einzelheiten der Mitochondrien und Chloroplasten einerseits und ihren potentiellen Vorläufern andererseits befaßte, um so größer wurde die Zahl an Übereinstimmungen, und um so unwahrscheinlicher wurde, daß die Organellen de novo parallel zu den Prokaryoten entstanden sind.
Die Argumentation scheint zwar auf den ersten Blick nicht in allen Punkten zwingend zu sein, doch je mehr man erkannte, wie genetische Information in Zellen organisiert ist und verändert werden kann, um so leichter fiel es, scheinbare Widersprüche aus dem Wege zu räumen.
Was spricht dafür, daß Mitochondrien aus Bakterien hervorgegangen sind? Mitochondrien sind semiautonom arbeitende Organellen. Sie enthalten DNS und eine Proteinsynthesemaschinerie. Ihre Ribosomen gehören zum Typ 70 S, die Proteinbiosynthese ist durch Chloramphenicol hemmbar. Im Gegensatz dazu findet man im Cytosol (der eukaryotischen Wirtszellen) nur Ribosomen des Typs 80S. Die Proteinsynthese dort ist durch Cycloheximid, aber nicht durch Chloramphenicol hemmbar.
Die DNS ist zirkulär (wie bei Bakterien; einschränkend sei aber vermerkt, daß fast alle DNS-Moleküle dieser Größenordnung unabhängig von ihrer Herkunft zirkulär sind). Sie ist nicht mit Histonen assoziiert. Ihr Informationsgehalt ist wesentlich geringer als der irgendeiner Bakterienart. Es wird argumentiert: die übrige Information verlor für den Symbionten an Wert und ging daher im Verlauf der Vervollkommnung der Symbiose verloren. Es gibt mittlerweile aber auch Hinweise (und die Notwendigkeit?) für die Inkorporation eines Teils der ursprünglichen mitochondrialen DNS in das Kerngenom.
Mitochondrien haben keine Zellwand. In ihrer inneren Membran enthalten sie bestimmte Lipide, die sonst nur noch bei Bakterien zu finden sind. Man vermutet, daß die äußere Mitochondrienmembran von der Wirtszelle beigesteuert wird und daß sie einer Phagozytosemembran homolog ist. In ihrer Lipidzusammensetzung unterscheidet sie sich nicht von den übrigen Membranen der Wirtszelle.
Die für die Atmungskette benötigten Enzyme sind in der Plasmamembran von Bakterien und der inneren Membran der Mitochondrien in gleichartiger Weise angeordnet. Die notwendigen Proteine sind einander homolog. Die größte Übereinstimmung besteht zwischen der Atmungskette der Mitochondrien und der der Rhodospirillen.
Es gibt nur sehr wenige rezente mitochondrienfreie Eukaryotenzellen. Zu ihnen gehört die Amöbe Pelomyxa palustris. Sie wiederum lebt in Symbiose mit aerob lebenden, von einer Zellwand umgebenen Bakterien. Diese Beobachtung ist ein wichtiger Hinweis auf das Zustandekommen von Endosymbiosen unter natürlichen Bedingungen.
So wie man die Mitochondrien auf ursprünglich endosymbiotisch lebende Bakterien zurückführen kann, lassen sich die Chloroplasten (Plastiden) mit blaualgenähnlichen Prokaryoten homologisieren. Plastidenhaltige Organismen können durchweg als Pflanzen charakterisiert werden. Als zweifelhaft mag man vielleicht die Stellung von Euglena, einer chloroplastenhaltigen Flagellatengruppe (Euglenophyta) ansehen, denn im Gegensatz zu den echten Pflanzen gibt es plastidenfreie Mutanten von sonst plastidenhaltigen Arten, und es gibt Arten, denen die Plastiden ganz fehlen. Welche Ähnlichkeiten bestehen zwischen Chloroplasten (und den von ihnen abgeleiteten übrigen Plastiden) und den Blaualgen, bzw. ihren Vorfahren (oder ihnen nahestehenden Formen)?
Es besteht ein hoher Homologiegrad zwischen rRNS aus Chloroplasten und aus rezenten Blaualgen, der in der Ausbildung nahezu identischer Sekundärstrukturen zum Ausdruck kommt. Aber: In der Chloroplasten-DNS wurden Introns nachgewiesen, in der Blaualgen-DNS (noch?) nicht.
Chloroplasten und Blaualgen enthalten die Photosysteme I und II. Es besteht weitgehende Übereinstimmung in bezug auf die einzelnen Reaktionsschritte. Aber: Die Chloroplasten der grünen Pflanzen enthalten die Chlorophylle a und b, doch Chlorophyll b fehlt den rezenten Blaualgen. Diese wiederum verfügen über Chlorophyll a und Phycobiline (Phycocyanin, Phycoerythrin). Eine solche Kombination kommt auch in den Plastiden der Rotalgen vor.
Die kleine und die große ribosomale Untereinheit aus Chloroplasten und Bakterien komplementieren einander. Durch Rekonstitutionsexperimente wurde gezeigt, daß einzelne ribosomale Proteine der Chloroplasten durch die homologen Proteine aus Bakterien ersetzt werden können.
Die DNS der Chloroplasten enthält ebenso wie die der Mitochondrien nur relativ wenig genetische Information. Viele der in Chloroplasten nachgewiesenen (und dort benötigten) Proteine sind kerncodiert. Der Vergleich der ATP-Synthetase aus Mitochondrien verschiedener Herkunft mit der aus Chloroplasten zeigt, daß das Enzym beider Organellen viele Ähnlichkeiten aufweist. Es besteht aus mehreren Untereinheiten (Polypeptidketten); die dafür benötigten Gene sind teils im Kern, teils in den Organellen selbst lokalisiert. Die als Schema wiedergegebenen Ergebnisse veranschaulichen, daß nicht immer der gleiche Satz an Genen im Kern respektive in den Organellen lokalisiert ist.
Bei einigen Algen (und Flagellaten) sind sogenannte Cyanellen identifizert worden. Dabei handelt es sich um Einschlüsse, die eine Art Zwischenstellung zwischen Blaualgen und Chloroplasten einnehmen. So enthalten z.B. die Cyanellen des Flagellaten Cyanophora paradoxa (wie die Chloroplasten) nur etwa 5-10 Prozent der DNS des Blaualgengenoms. Sie sind von einer mureinhaltigen Wand umgeben und in intrazellulären Vesikeln lokalisiert. Die Gene für die große und die kleine Untereinheit der Ribulose-1,5-Bisphosphatcarboxylase liegen auf dem Cyanellengenom. In grünen Pflanzen ist die kleine Untereinheit kerncodiert, die große plastidencodiert (s. folgenden Abschnitt). Cyanellen und Wirtszellen sind aufeinander angewiesen, sie sind nicht getrennt kultivierbar. Die Integration zwischen ihnen ist demnach bereits weit fortgeschritten, jedoch noch nicht so perfektioniert wie die zwischen den Chloroplasten und ihren Wirtszellen.
1976 entdeckte R. A. LEWIN eine in Zellen eines Schwammes endosymbiotisch lebende, blaualgenähnliche Art (Prochloron), die die Chlorophylle a und b besitzt und deren Thylakoide sich in einer Form stapeln, die für Chloroplasten typisch ist. Daher wurde die Vermutung geäußert, Prochloron-ähnliche Blaualgen kämen als Vorfahren der Chloroplasten eher in Betracht als die übrigen rezenten Arten. Da Prochloron aber in vielen anderen Merkmalen zu spezialisiert ist, mußte diese Annahme jedoch zunächst als unwahrscheinlich verworfen werden.
1986 beschrieb eine holländische Arbeitsgruppe (T. BURGER-WIERSMA und Mitarbeiter) eine weitere Prochloron-ähnliche Art (Prochlorothrix hollandica), die sie 1984 aus einem flachen, eutrophen See (Loosdrechtsee) isolierte, in dem sie in Massen auftrat. Die Zellen sind langgestreckt, die Pigmentzusammensetzung ähnelt der der Chloroplasten grüner Pflanzen (T. BURGER-WIERSMA, 1991).
Wegen der großen Unterschiede im Pigmentmuster und der Ultrastruktur der Chloroplasten von Rotalgen, Braunalgen (und Diatomeen) sowie der grünen Pflanzen, sieht es so aus, als sei die Initiation der Endosymbiose nicht auf ein einziges Ereignis zurückzuführen, sondern auf einen getrennten Erwerb von Plastiden in den genannten Pflanzengruppen. Das Pflanzenreich ist demnach polyphyletischen Ursprungs. Die Endosymbionten gehörten vermutlich verschiedenen Blaualgengruppen an (s.a. Punkt 4).
Die ATP-Synthetase in Bakterien und in Blaualgen ähnelt der aus Organellen und besteht aus der gleichen Zahl an Untereinheiten. Dieser Befund weist darauf hin, daß das Enzym prokaryotischen Ursprungs ist und daß im Verlauf der Evolution Gene aus den Endosymbionten oder den daraus abgeleiteten Organellen in den Kern der Wirtszelle eingewandert sind und in das dortige Genom inkorporiert wurden. Die vorgetragenen Ergebnisse weisen zudem darauf hin, daß die Wanderungen einzelner Gene als voneinander unabhängige Ereignisse zu betrachten sind.
Bei einigen coccalen (runden, einzelligen) Algen (z.B. Glaucosphaera vacuolaria) kommen ganz oder fast wandlose Cyanellen vor. Einige marine chloroplastenhaltige Bacillariophyceen (Diatomeen) können fakultativ in Symbiose mit der fädigen Blaualge Richelia leben. Der Symbiont wird ins Plasma der Wirtszelle integriert. Gerade das zuletzt genannte Beispiel einer unvollkommenen (und reversiblen) Integration ist ein guter Beleg dafür, daß Endosymbiosen immer wieder auftreten können. Die übrigen Beispiele belegen, daß einzelne Schritte, die zur Umwandlung eines Prokaryoten in ein Organell führten, getrennt und unabhängig voneinander erfolgten. Cyanellen sind daher gute Modelle, um den Integrationsprozeß im Detail zu analysieren.
Die unter (4.) und bei der Behandlung der Mitochondrien vorgebrachten Argumente weisen darauf hin, daß sich eine diffizil regulierte Integration der Endosymbionten entwickelt hat, die letztlich dazu führte, daß sowohl Mitochondrien als auch Chloroplasten für ihre Wirtszellen unentbehrlich wurden. Es gibt nämlich - außer in den schon genannten Einzelfällen - keine organellenfreien Eukaryotenzellen.
Wie wirkt sich die Kooperation zwischen den einzelnen Kompartimenten der Zelle (Plastiden, Mitochondrien, Cytosol, Kern) aus?
Viel Aufmerksamkeit wurde dem Studium jener Proteine entgegengebracht, die - wie die ATP-Synthetase - aus mehreren Untereinheiten bestehen und für deren Entstehung ein Zusammenwirken verschiedener Genome erforderlich ist.
Die Ribulose-1,5-Bisphosphat-Carboxylase (Rubisco, Fraction-1-Protein) ist das mengenmäßig häufigste Protein, das es überhaupt gibt. Es besteht aus großen und kleinen Untereinheiten, die in Eukaryoten kerncodiert (kleine U.E.) bzw. chloroplastencodiert (große U.E.) sind. Das Protein kommt auch in Blaualgen vor, wo die Gene in einem Genom vereint sind. Auch bei einer Cyanelle (Cyanophora paradoxa, s. vorangegangenen Abschnitt) sind beide Gene im Cyanellengenom lokalisiert. Eine intraspezifische Variabilität der großen und der kleinen Untereinheit ist durch isoelektrische Fokussierung (einer Variante elektrophoretischer Trennung) nachweisbar. Die Analyse der Variabilität dieses Proteins in der Gattung Nicotiana eröffnete eine neue Möglichkeit, stammesgeschichtliche Zusammenhänge zwischen einzelnen Arten abzuleiten.
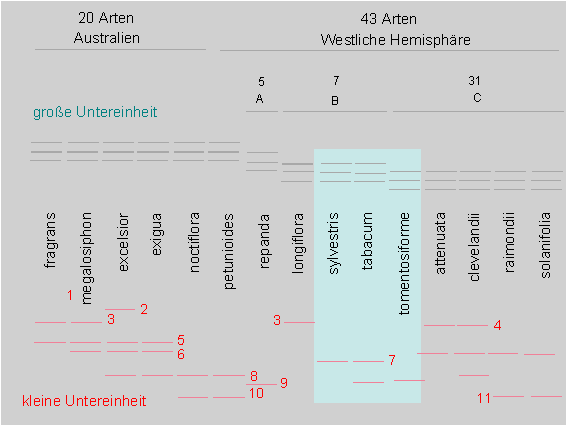
Diagrammatische Darstellung der Anzahl und Position der großen und kleinen Untereinheiten der Ribulosebisphosphatcarboxylase des Tabaks nach Auftrennung durch isoelektrische Fokusssierung. Lateinische Namen und Bezeichnungen (Epitheta) von Nicotiana-Arten. Deutlich zu erkennen ist, daß das Muster der großen U. E. bei allen australischen Arten und einigen Arten der westlichen Hemisphäre gleich ist. Die übrigen Arten fallen in drei weitere Gruppen (A, B, C). Die Variabilität innerhalb der kleinen U. E. ist weit höher als die der großen (Nach K. Chen, S. JOHAL, S. G. WILDMAN, 1976). Weiteres s. Text. Aufgrund dieser Daten kann ein Dendrogramm erstellt werden.
Die große Untereinheit variiert weniger stark als die kleine. Das wiederum mag vielleicht auf die hochgradige Polyploidie des Plastidengenoms zurückzuführen sein. In jeder Zelle findet man nämlich viele Plastiden, und innerhalb eines jeden mehrere (gleichwertige) DNS-Moleküle. Die Wahrscheinlichkeit, daß sich unter diesen Bedingungen eine Mutante durchsetzt, ist weit geringer als im diploiden Kerngenom.
Auch für die kleine Untereinheit werden meist mehr als zwei Banden im Gel gefunden (was zu erwarten ist, wenn das Gen in zwei verschiedenen Allelen vorliegt). Die Ursache hierfür sind Isoenzyme, also Produkte verschiedener Gene, die durch Genduplikation oder (Allo-)polyploidie entstanden sind. Letzteres ist für viele Nicotiana-Arten typisch. Nicotiana rustica (n = 24) ist aus einer Kreuzung von Nicotiana undulata (n = 12) x Nicotiana paniculata (n = 12), und Nicotiana arentsii (n = 24 ) aus einer Kreuzung von Nicotiana wigandioides (n = 12) x Nicotiana undulata (n = 12) hervorgegangen. Die Bastarde enthalten die Genprodukte [hier: kleine Untereinheit (Polypeptidkette) von Rubisco] der beiden Elternarten; beide werden gleich stark exprimiert. Die große Untereinheit wird durch das Chloroplastengenom codiert, folglich findet sich im Bastard nur der Genotyp des weiblichen Elters (Kreuzungspartners).
Mit der hier skizzierten Methode gelang übrigens auch der Nachweis, daß die Art Nicotiana tabacum (n = 24) ein amphidiploider (= allotetraploider) Bastard aus weiblich Nicotiana sylvestris und männlich Nicotiana tomentosiformis ist. Nicotiana tabacum enthält nämlich den gleichen Typ großer Untereinheiten wie Nicotiana sylvestris, und die wieder können nur durch das mütterliche Plasma in die neue Art (den Bastard) Nicotiana tabacum eingeführt worden sein.
Der interspezifischen Variation von Rubisco kann eine intraspezifische überlagert sein. Nicotiana suaveolens z.B. ist phänotypisch hochgradig polymorph. Die große Untereinheit ist in allen Populationen gleich, die kleine variiert. Durch Kreuzungsexperimente wurde gezeigt, daß es sich um Alloenzyme handelt.
Wegen der verbreiteten Allopolyploidie in der Gattung Nicotiana (und anderen) darf das durch Auswertung von Alloenzymdaten erstellte Dendrogramm nicht kritiklos mit einem Stammbaum der Gattung Nicotiana verwechselt werden.
Um Aussagen über phylogenetische Zusammenhänge abzusichern, müssen morphologische, karyologische und proteinchemische Daten miteinander in Einklang gebracht werden. Beispiele, bei denen das schon gelang, sind die Gattungen Brassica, Triticum und Solanum.
|
|